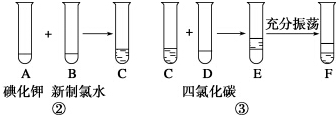
题目内容
7.在25℃时,密闭容器中X,Y,Z三种气体的初始物质的量和平衡物质的量如表:| 物质 | X | Y | Z |
| 初始物质的量/mol | 0.1 | 0.2 | 0 |
| 平衡物质的量/mol | 0.05 | 0.2 | 0.1 |
| A. | 反应达到平衡时,X的转化率为50% | |
| B. | 反应可表示为X+2Y?2Z | |
| C. | 增大压强使平衡向生成Z的方向移动 | |
| D. | 若起始时X,Y,Z物质的量分别为0.1mol、0.4mol、0.2mol,达平衡时,Z的体积分数一定增大 |
分析 A.根据转化率=$\frac{物质的量变化量}{起始物质的量}$×100%计算;
B.Y的物质的量不变,则Y不参与反应,物质的量变化量之比等于化学计量数之比,据此判断化学方程式;
C.增大压强平衡向气体体积减小的方向移动;
D.等效为在原平衡的基础上压强增大一倍,结合平衡移动判断.
解答 解:A.反应达到平衡时,X的转化率为:$\frac{0.1mol-0.05mol}{0.1mol}$×100%=50%,故A正确;
B.Y的物质的量不变,则Y不参与反应,化学计量数之比等于物质的量变化量之比,而△n(X):△n(Z):=0.05:0.1=1:2,则反应的方程式为X?2Z,故B错误;
C.反应的方程式为:X(g)?2Z(g),正反应为气体体积增大的反应,增大压强平衡向生成X的方向移动,故C错误;
D.等效为在原平衡的基础上压强增大一倍,平衡向逆反应方向移动,平衡时Z的体积分数一定减小,故D错误,
故选A.
点评 本题考查化学平衡计算、化学平衡影响因素、等效平衡等,侧重考查学生对知识的理解,难度中等.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案
相关题目
13.有FeO、Fe2O3的混合物若干克,在足量氢气中加热充分反应,冷却后称得剩余固体比原混合物减轻了8克;将等质量的原混合物与盐酸反应,欲使之完全溶解,需1mol/L的盐酸的体积至少为( )
| A. | 0.5L | B. | 0.1L | C. | 2L | D. | 1L |
19.下列说法错误的是( )
| A. | CCl4可由CH4制得,可萃取碘水中的碘 | |
| B. | 乙酸分子中含有羧基,乙酸的酸性比碳酸弱 | |
| C. | 乙醇、乙酸都能发生酯化反应 | |
| D. | 只用水就能鉴别苯和四氯化碳 |
16.下列四组物质中互为同素异形体的是( )
| A. | D和T | B. | 12CO和14CO | C. | CH3CHO与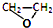 | D. | 16O2和18O3 |
 氯乙烷跟化合物之间的转化如图所示:
氯乙烷跟化合物之间的转化如图所示: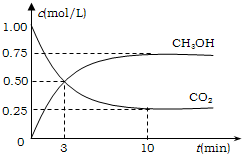 工业设计用CO2来生产燃料甲醇,既减少二氧化碳气体,又得到了宝贵的能源物质.为了探究反应原理,先进行如下实验:在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,在某温度下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示.
工业设计用CO2来生产燃料甲醇,既减少二氧化碳气体,又得到了宝贵的能源物质.为了探究反应原理,先进行如下实验:在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,在某温度下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示.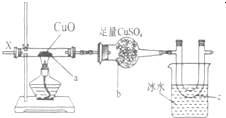 按图装置,持续通入X气体,可以看到a处有红色物质生成,b处变蓝,c处得到刺激性气味的液体,则X气体可能是( )
按图装置,持续通入X气体,可以看到a处有红色物质生成,b处变蓝,c处得到刺激性气味的液体,则X气体可能是( )