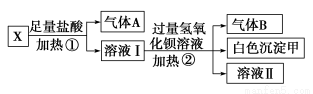
题目内容
在热的稀硫酸中溶解了11.4 g FeSO4固体,当加入50 mL 0.5 mol·L-1 KNO3溶液时,其中的Fe2+全部转化成Fe3+,KNO3也完全反应并放出NxOy气体。
(1)推算出x= ;y= 。
(2)配平该反应的方程式:
FeSO4+ KNO3+ H2SO4= K2SO4+ Fe2(SO4)3+  (NxOy)+ H2O(配平时x、y用具体数值表示,物质填在
(NxOy)+ H2O(配平时x、y用具体数值表示,物质填在 中)。
中)。
(3)反应中氧化产物是 。
(4)用双线桥法表示该反应中的电子转移方向和数目: 。
(1)1 1 (2)6 2 4 1 3 2 NO↑ 4
(3)Fe2(SO4)3
(4)

+4H2O
【解析】n(FeSO4)=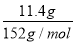 =0.075 mol
=0.075 mol
n(KNO3)=0.05 L×0.5 mol·L-1=0.025 mol
Fe2+转化为Fe3+共失去0.075 mol电子,根据得失电子守恒原理,可知1 mol N原子得到3 mol电子,反应中N元素由+5价降为+2价,既得到的氧化物为NO。

练习册系列答案
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案
相关题目