题目内容
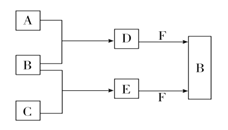
【题目】氯化钾样品中含有少量碳酸钾、硫酸钾和不溶于水的杂质。为了提纯氯化钾,先将样品溶于适量水中,充分搅拌后过滤,再将滤液按下图所示步骤进行操作。
回答下列问题:

(1)①中发生反应的化学方程式为__________。
(2)②中加入试剂Ⅱ的目的是__________。
(3)操作④为蒸发,蒸发的作用之一是得到KCl晶体,另一作用是__________。
(4)某同学称取提纯的产品0.76g,溶解后定容在100mL容量瓶中,取25.00mL溶液,与25.00mL浓度为0.1000mol/L的硝酸银溶液恰好完全反应,则该产品的纯度为__________。
【答案】
(1)BaCl2+K2SO4=BaSO4↓+2KCl;BaCl2+K2CO3=BaCO3↓+2KCl
(2)除去过量的 Ba2+
(3)除去多余的盐酸(4)98%
【解析】
试题分析:氯化钾样品中含有少量碳酸钾、硫酸钾和不溶于水的杂质,除去碳酸根离子和硫酸根离子,需要加入过量的氯化钡溶液,然后过滤后得到氯化钡、氯化钾的混合溶液A,然后加入过量的碳酸钾溶液,除去氯化钡,过滤得到氯化钾和碳酸钾的混合溶液,再加入过量的盐酸,除去碳酸钾,最后经过加热浓缩,蒸发结晶,过滤得到氯化钾晶体。
(1)①中发生的所有反应是硫酸钾和氯化钡反应生成硫酸钡沉淀和氯化钾,碳酸钾和氯化钡反应生成碳酸钡沉淀和氯化钾,化学方程式为:K2SO4+BaCl2=BaSO4↓+2KCl,K2CO3+BaCl2=BaCO3↓+2KCl,故答案为:K2SO4+BaCl2=BaSO4↓+2KCl,K2CO3+BaCl2=BaCO3↓+2KCl;
(2)②中加入试剂2的目的是除过量BaCl2,故答案为:除过量BaCl2;
(3)E之后需要进行蒸发,蒸发的作用之一是得到KCl晶体,另一作用是:除去多余的盐酸,故答案为:除去多余的盐酸;
(4)设25mL氯化钾溶液中氯化钾的物质的量为nmol。
KCl+AgNO3=AgCl+KNO 3
1mol 1mol
Nmol 0.1000molL-1 ×0.02562L
n=0.002562mol,
100mL溶液中含有氯化钾的物质的量=0.002562mol×4=0.010248mol,
100mL溶液中含有氯化钾的质量=0.010248mol×74.5g/mol=0.764376g,
质量分数=![]() ×100%=98.40%,故答案为:98.40%。
×100%=98.40%,故答案为:98.40%。