题目内容
【题目】溴和碘的化合物在生产和生活中有广泛的用途.
(1)市场销售的某种食用精制盐中含碘酸钾。
①碘酸钾与碘化钾在酸性条件下发生如下反应,配平该反应的化学方程式:
![]()
②上述反应生成的I2可用四氯化碳检验,现象为________________________。
向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。
Na2SO3稀溶液与I2反应的离子方程式是________________________。
(2)海水提溴过程中溴元素的变化如下:
![]()
①过程I,海水显碱性,调其pH<3.5后,再通入氯气,调节海水pH可提高C12的利用率,用平衡原理解释其原因是_______________________。
②过程II,用热空气将溴赶出,再用浓Na2CO3溶液吸收。完成并配平下列方程式。
![]()
③过程III,用硫酸酸化可得Br2和Na2SO4的混合溶液。相同条件下,若用盐酸酸化,则所得溴的质量减少,原因是_________________________。
④NaBrO3是一种分析试剂。向硫酸酸化的NaI溶液中逐滴加入NaBrO3溶液,当加入 2.6molNaBrO3时,测得反应后溶液中溴和碘的存在形式及物质的量分别为:
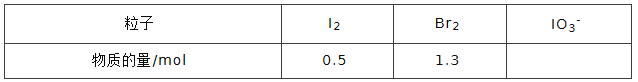
则原溶液中NaI的物质的量为_________mol.
【答案】
(1)①1;5;3;3;3;3;②下层溶液显紫色;I2+SO32-+H2O=2I-+SO42-+2H+;
(2)①通入Cl2发生歧化反应;Cl2+H2O=H++Cl-+HClO,增大c(H+),平衡逆向移动,抑制Cl2与水的反应;②3;3;1;3;5NaBr;③盐酸有还原性,与溴酸根反应;④3。
【解析】
试题分析:(1)KIO3中I元素的化合价由+5价降低为0,KIO3为氧化剂,KI中I元素的化合价由-1价升高为0,KI为还原剂,由电子守恒及质量守恒定律可知,反应为KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O,故答案为:1;5;3;3;3;3;
②向溶液中加入四氯化碳,下层溶液显紫色;Na2SO3稀溶液与I2反应Na2SO3稀溶液具有还原性被氧化为硫酸钠,I2具有氧化性,被还原为I-,结合反应的电荷守恒和原子守恒配平写出离子方程式,Na2SO3稀溶液与I2反应的离子方程式是:I2+SO32-+H2O=2I-+SO42-+2H+,故答案为:下层溶液显紫色;I2+SO32-+H2O=2I-+SO42-+2H+;
(2)①调节海水pH可提高Cl2的利用率,原因是通入后发生反应Cl2+H2O→Cl-+H++HClO,增大c(H+),平衡逆向移动,抑制Cl2与水反应,故答案为:通入Cl2发生歧化反应;Cl2+H2O=H++Cl-+HClO,增大c(H+),平衡逆向移动,抑制Cl2与水的反应;
②过程II,用热空气可将溴吹出;再用浓碳酸钠溶液吸收,反应的方程式为3Br2+3Na2CO3→1NaBrO3+3CO2+5NaBr,故答案为: 3; 3; 1;3; 5NaBr;
③过程III中用硫酸酸化可得Br2和Na2SO4的混合溶液.相同条件下,若用盐酸酸化,由于溴酸根具有氧化性,氯离子具有还原性,发生氧化还原反应,导致一部分溴反应掉,则所得溴的质量减少,故答案为:盐酸有还原性,与溴酸根反应;
④2.6mol NaBrO3反应生成溴单质时转移的电子数为2.6×5=13mol,生成碘为0.5mol,转移的电子为1mol,则生成IO3-转移的电子数为12mol,生成IO3-的物质的量为2mol,根据碘原子守恒,则原溶液中NaI的物质的量为2+1=3mol,故答案为:3。