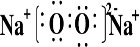题目内容
(1)写出CO2与Na2O2反应的化学方程式:______________________________。(2)某学生判断SO2和Na2O2反应能生成硫酸钠,你认为他的判断合理吗?___________。简要说明理由_________________________________________________________________。
(3)该同学无法断定SO2和Na2O2反应中是否有氧气生成,拟用下列装置进行实验。
(已知:Na2SO3+2H2SO4![]() Na2SO4+H2O+SO2↑)
Na2SO4+H2O+SO2↑)

装置B的作用是__________________________________________________________。
D的作用是____________________________________________________________。
(4)为确认SO2和Na2O2的反应产物,该同学设计了以下实验步骤,请你从中挑选出正确的选项并按操作顺序排列(填序号)_______________。
A.用带火星的木条靠近干燥管口,观察木条是否复燃
B.用C装置中反应后的固体物质溶于适量水配成溶液
C.在配成的溶液中加入用硝酸酸化的硝酸钡溶液,观察是否有沉淀生成
D.在配成的溶液中先加入盐酸,再加入氯化钡溶液,观察是否有气泡或沉淀生成
思路解析:二氧化碳与过氧化钠的反应是同学们熟悉的,二氧化硫与过氧化钠的反应则需要进行类推迁移,但生成的亚硫酸钠可进一步被氧化成硫酸钠。
答案:(1)2CO2+2Na2O2![]() 2Na2CO3+O2
2Na2CO3+O2
(2)合理 Na2O2具有氧化性,SO2具有还原性,SO2被Na2O2氧化成Na2SO4
(3)除去SO2中混有的水蒸气,防止水蒸气与Na2O2反应生成O2 除去未反应的SO2,防止污染空气
(4)ABD

(10分)通常人们把拆开1mol 某化学键所吸收的能量看成该化学键的键能。键能的大小可用于估算化学反应的反应热(△H)。
|
化学键 |
Cl-Cl |
H—H |
H—Cl |
N≡N |
|
键能/kJ·mol |
243 |
436 |
431 |
946 |
(1)按要求完成填空
a 2HCl(g) = H2(g)+Cl2(g);△H=
b N2 (g)+3H2(g) = 2NH3(g) ΔH=-92 kJ/mol,则N—H键的键能是 kJ·mol
(2)1 mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式

(3) 已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH1
② 2CO (g)+ O2(g) = 2CO2(g) ΔH2
③ H2O(g) = H2O(l) ΔH3
则CH3OH(l)+O2(g)= CO(g) + 2H2O(l)ΔH = (用含ΔH1、ΔH2、ΔH3的式子表示)
(4) 已知:2Al (s)+ 3/2O2(g)==Al2O3(s) △H= -1 644.3 kJ• mol-1
2Fe (s) +3/2O2(g)==Fe2O3(s) △H= -815.88 kJ• mol-1
试写出铝粉与氧化铁粉末发生铝热反应的热化学方程式_______________________。
 (2013?淄博二模)(1)写出Co2+离子基态的价电子排布式:
(2013?淄博二模)(1)写出Co2+离子基态的价电子排布式: 通常人们把拆开1mol 某化学键所吸收的能量看成该化学键的键能.键能的大小可用于估算化学反应的反应热(△H).
通常人们把拆开1mol 某化学键所吸收的能量看成该化学键的键能.键能的大小可用于估算化学反应的反应热(△H).