题目内容
 通常人们把拆开1mol 某化学键所吸收的能量看成该化学键的键能.键能的大小可用于估算化学反应的反应热(△H).
通常人们把拆开1mol 某化学键所吸收的能量看成该化学键的键能.键能的大小可用于估算化学反应的反应热(△H).| 化学键 | Cl-Cl | H-H | H-Cl | N≡N |
| 键能/kJ?mol | 243 | 436 | 431 | 946 |
a 2HCl(g)=H2(g)+Cl2(g);△H=
+183kJ/mol
+183kJ/mol
b N2(g)+3H2(g)=2NH3(g)△H=-92kJ/mol,则N-H键的键能是
391
391
kJ?mol(2)1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式
NO2(g)+CO(g)=CO2(g)+NO(g)
NO2(g)+CO(g)=CO2(g)+NO(g)
△H=-234kJ?mol-1
△H=-234kJ?mol-1
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H1
②2CO (g)+O2(g)=2CO2(g)△H2
③H2O(g)=H2O(l)△H3
则CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
(4)已知:2Al (s)+
| 3 |
| 2 |
2Fe (s)+
| 3 |
| 2 |
试写出铝粉与氧化铁粉末发生铝热反应的热化学方程式
2Al(s)+Fe2O3(s)═Al2O3(s)+2Fe(s)△H=-828.42kJmol-1
2Al(s)+Fe2O3(s)═Al2O3(s)+2Fe(s)△H=-828.42kJmol-1
.分析:(1)根据反应热的计算公式计算;
(2)根据能量变化图,用生成物的能量减反应物的能量就是该反应热.
(3)把已知反应方程式通过变化变成所求方程式,并且反应热进行相应的变化,最后所得能量就是所求反应的反应热.
(4)把已知反应方程式通过变化变成所求方程式,并且反应热进行相应的变化,最后所得能量就是所求反应的反应热.
(2)根据能量变化图,用生成物的能量减反应物的能量就是该反应热.
(3)把已知反应方程式通过变化变成所求方程式,并且反应热进行相应的变化,最后所得能量就是所求反应的反应热.
(4)把已知反应方程式通过变化变成所求方程式,并且反应热进行相应的变化,最后所得能量就是所求反应的反应热.
解答:解:(1)a 2HCl(g)=H2(g)+Cl2(g);△H=(2×431)kJ?mol-1-(436kJ?mol-1+243 kJ?mol-1)
═+183 kJ/mol
b N2(g)+3H2(g)=2NH3(g)△H=-92kJ/mol,
△H=946 kJ/mol+(3×431)kJ/mol-3×2×N-H键的键能=-92kJ/mol,
所以N-H键的键能=391 kJ/mol
故答案为:+183 kJ/mol; 391
(2)因反应物的物质的量都为1mol,所以其反应物的计量数为1,再根据原子守恒配平方程式;
根据图象知,△H=-(E2-E1)=-(368-134)kJ/mol=-234 kJ?mol-1
故答案为:NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234 kJ?mol-1
(3)①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H1
②2CO (g)+O2(g)=2CO2(g)△H2
③H2O(g)=H2O(l)△H3
则CH3OH(l)+O2(g)=CO(g)+2H2O由
①-
②+2③得到,
所以△H=
△H1-
△H2+2△H3
故答案为:
△H1-
△H2+2△H3
(4)铝热反应的反应物是铝粉与氧化铁粉末,生成物是铁和氧化铝,
2Al (s)+
O2(g)═Al2O3(s)△H=-1 644.3kJ?mol-1 ①
2Fe (s)+
O2(g)═Fe2O3(s)△H=-815.88kJ?mol-1 ②
方程式①-②得2Al (s)+Fe2O3(s)
Al2O3(s)+2Fe (s)
所以△H=△H(①)-△H(②)=-1 644.3kJ?mol-1-(-815.88kJ?mol-1)
=-828.42 kJ mol-1
故答案为:2Al (s)+Fe2O3(s)═Al2O3(s)+2Fe (s)△H=-828.42 kJ mol-1
═+183 kJ/mol
b N2(g)+3H2(g)=2NH3(g)△H=-92kJ/mol,
△H=946 kJ/mol+(3×431)kJ/mol-3×2×N-H键的键能=-92kJ/mol,
所以N-H键的键能=391 kJ/mol
故答案为:+183 kJ/mol; 391
(2)因反应物的物质的量都为1mol,所以其反应物的计量数为1,再根据原子守恒配平方程式;
根据图象知,△H=-(E2-E1)=-(368-134)kJ/mol=-234 kJ?mol-1
故答案为:NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234 kJ?mol-1
(3)①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H1
②2CO (g)+O2(g)=2CO2(g)△H2
③H2O(g)=H2O(l)△H3
则CH3OH(l)+O2(g)=CO(g)+2H2O由
| 1 |
| 2 |
| 1 |
| 2 |
所以△H=
| 1 |
| 2 |
| 1 |
| 2 |
故答案为:
| 1 |
| 2 |
| 1 |
| 2 |
(4)铝热反应的反应物是铝粉与氧化铁粉末,生成物是铁和氧化铝,
2Al (s)+
| 3 |
| 2 |
2Fe (s)+
| 3 |
| 2 |
方程式①-②得2Al (s)+Fe2O3(s)
| ||
所以△H=△H(①)-△H(②)=-1 644.3kJ?mol-1-(-815.88kJ?mol-1)
=-828.42 kJ mol-1
故答案为:2Al (s)+Fe2O3(s)═Al2O3(s)+2Fe (s)△H=-828.42 kJ mol-1
点评:解答本题注意:
1、一个 NH3分子含有3个氮氢键.
2、方程式进行加减时乘除时,反应热要相应的变化.
1、一个 NH3分子含有3个氮氢键.
2、方程式进行加减时乘除时,反应热要相应的变化.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
 通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,也可以估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.
通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,也可以估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.| 化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C |
| 键能/kJ?mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
(1)比较下列两组物质的熔点高低(填“>”或“<”)SiC
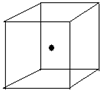
(2)如图立方体中心的“●”表示硅晶体中的一个原子,请在立方体的顶点用“●”表示出与之紧邻的硅原子.
(3)工业上用高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)
| ||
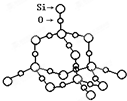 (1)下列数据是对应物质的熔点(℃)
(1)下列数据是对应物质的熔点(℃)