题目内容
【题目】七铝十二钙 (12CaO·7Al2O3)是一种新型的超导材料和发光材料,它是用一定量的CaCO3溶解于酸性AlCl3溶液,再用氨水沉淀,然后煅烧沉淀制备。工业上制备七铝十二钙的流程如下图: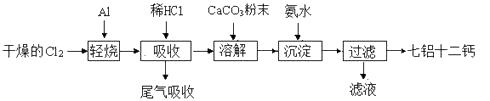
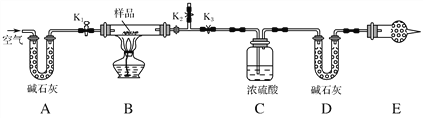
(1)轻烧后产生的AlCl3蒸气易凝华,为防止堵塞导气管可采取的措施为。
(2)吸收时用稀盐酸溶解的原因是。
(3)AlCl3溶液溶解CaCO3时,要控制碳酸钙和AlCl3的量,要求n(CaCO3)∶n(AlCl3)> 12∶14,其原因是。但若加入CaCO3过多,会产生的后果是。
(4)沉淀、过滤后的滤液主要成分是。
(5)以工业碳酸钙(含有少量Al2O3、Fe3O4杂质)生产二水合氯化钙(CaCl2·2H2O)的方法为:将工业碳酸钙溶于盐酸,加入双氧水, , 冰水洗涤,干燥,得到CaCl2·2H2O(实验中需用到的试剂和仪器有:盐酸,双氧水,氢氧化钙,冰水,pH计)。
已知:几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol/L计算):
开始沉淀的pH | 完全沉淀的pH | |
Fe3+ | 1.1 | 3.2 |
Al3+ | 3.5 | 4.7 |
【答案】
(1)加热导管、加粗导管
(2)抑制铝离子水解
(3)氢氧化钙微溶于水,造成损失;产生氢氧化铝沉淀
(4)NH4Cl(少量 CaCl2)
(5)加入氢氧化钙,搅拌,用pH计调节溶液的pH为4.7,过滤,向滤液中加盐酸酸化,蒸发浓缩,冷却结晶,过滤
【解析】解: (1) AlCl3易凝华,为了防止AlCl3蒸气凝华堵塞导气管,轻烧后的气体用水处理前导气管要保温或加粗处理;(2)AlCl3易水解,为抑制铝离子水解,用吸收时用盐酸吸收,(3)七铝十二钙(12CaO·7Al2O3)中钙、铝元素的物质的量比12:14,氢氧化钙微溶于水,造成损失,所以AlCl3溶液溶解CaCO3时要求n(CaCO3):n(AlCl3)>12:14。若碳酸钙加入过多,会导致铝离子水解生成氢氧化铝沉淀;(4)根据元素守恒用氨水沉淀、过滤后的滤液主要成分是NH4Cl; (5)将工业碳酸钙溶于盐酸,加入双氧水,把Fe2+氧化为Fe3+ , 加入氢氧化钙,搅拌,用pH计调节溶液的pH为4.7,过滤,向滤液中加盐酸酸化,蒸发浓缩,冷却结晶,过滤,冰水洗涤,干燥得到CaCl2·2H2O。