题目内容
15.根据实验回答问题:(1)在一支试管中加入2mL 0.1 mol•L-1的ZnSO4溶液,再滴加1 mol•L-1的Na2S溶液可观察到的现象是生成白色沉淀.
(2)静置后倾去上层清液,并用蒸馏水洗涤沉淀2~3次,然后向白色沉淀中滴加适量的0.1 mol•L-1的CuSO4溶液,振荡试管.观察到的现象是白色沉淀逐渐溶解,生成黑色沉淀.
(3)上述实验中反应的离子方程式是
①Zn2++S2-=ZnS↓.
②Cu2+(aq)+ZnS(s)=CuS(s)+Zn2+(aq).
(4)试用沉淀溶解平衡的原理分析解释(2)中实验现象的变化.
分析 (1)ZnS是不溶于水的白色沉淀;
(2)CuS是黑色沉淀,比ZnS更难溶;
(3)①Zn2+与S2-反应生成ZnS沉淀;
②是沉淀转化,ZnS沉淀转化为CuS沉淀;
(4)据CuS的Ksp和其Qc的大小比较分析.
解答 解:(1)ZnS不溶于水,向ZnSO4溶液中滴加Na2S溶液,会生成白色沉淀ZnS,故答案为:生成白色沉淀;
(2)向白色沉淀ZnS中滴加适量的0.1 mol•L-1的CuSO4溶液时,白色沉淀逐渐溶解,生成黑色沉淀CuS,故答案为:白色沉淀逐渐溶解,生成黑色沉淀;
(3)①向ZnSO4溶液中滴加Na2S溶液,会生成白色沉淀ZnS,反应的了离子方程式为Zn2++S2-=ZnS↓,故答案为:Zn2++S2-=ZnS↓;
②向白色沉淀ZnS中滴加适量的0.1 mol•L-1的CuSO4溶液时,白色沉淀逐渐溶解,生成黑色沉淀CuS,反应的离子方程式为Cu2+(aq)+ZnS(s)=CuS(s)+Zn2+(aq),
故答案为:Cu2+(aq)+ZnS(s)=CuS(s)+Zn2+(aq);
(4)ZnS饱和溶液中存在沉淀的溶解平衡,向白色沉淀ZnS中滴加适量的0.1 mol•L-1的CuSO4溶液时,c(Cu2+)•c(S2-)>Ksp(CuS),能够生成CuS沉淀,c(S2-)减小,促进ZnS溶解平衡正向移动,ZnS逐渐溶解,
故答案为:向ZnS沉淀中加入CuSO4溶液时,c(Cu2+)•c(S2-)>Ksp(CuS),能够生成CuS沉淀,c(S2-)减小,ZnS逐渐溶解.
点评 本题考查了沉淀的生成和转化,注意沉淀容易转化为更难溶的沉淀,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.下列物质不能通过化合反应直接制得的是( )
| A. | FeCl2 | B. | H2SiO3 | C. | NH4NO3 | D. | HCl |
3.同周期的X、Y、Z三种元素,已知其氢化物分别为XH3、H2Y、HZ,则下列判断正确的是( )
| A. | 原子半径 Z>Y>X | |
| B. | Z的非金属性最强 | |
| C. | 氢化物还原性XH3>H2Y>HZ,稳定性XH3>H2Y>HZ | |
| D. | 最高氧化物对应水化物H3XO4酸性最强 |
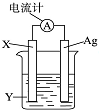 依据氧化还原反应:2Ag++Cu═Cu2++2Ag设计的原电池如图所示.请回答下列问题:
依据氧化还原反应:2Ag++Cu═Cu2++2Ag设计的原电池如图所示.请回答下列问题: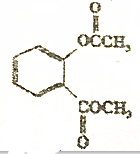 在稀硫酸加热时反应的化学方程式
在稀硫酸加热时反应的化学方程式 +CH3COOH+CH3OH.
+CH3COOH+CH3OH.

 .
.