题目内容
(1)化学实验中,常用沉淀法对溶液中的阳离子处理成沉淀进行分离.某溶液中含有Ag+、Ba2+、Cu2+三种金属阳离子,现欲用OH-、CO32-、Cl-三种不同阴离子使上述金属阳离子逐一形成沉淀.加入阴离子的顺序是:______
(2)有5瓶白色固体试剂,分别是Ba(NO3)2、KCl、NaOH、CuSO4、Na2SO4,现只提供蒸馏水,通过下面的实验步骤可鉴别它们.请填写下列空白:各取适量固体试剂分别加入5支试管中,加入适量蒸馏水,振荡试管,观察则可鉴别出一种物质,被检出的物质的化学式是______
(3)在KClO3+6HCl(浓)═KCl+3Cl2↑+3H2O的反应中,氧化剂是______,还原产物是______,试用双线桥法表示上述氧化还原反应______.
(2)有5瓶白色固体试剂,分别是Ba(NO3)2、KCl、NaOH、CuSO4、Na2SO4,现只提供蒸馏水,通过下面的实验步骤可鉴别它们.请填写下列空白:各取适量固体试剂分别加入5支试管中,加入适量蒸馏水,振荡试管,观察则可鉴别出一种物质,被检出的物质的化学式是______
(3)在KClO3+6HCl(浓)═KCl+3Cl2↑+3H2O的反应中,氧化剂是______,还原产物是______,试用双线桥法表示上述氧化还原反应______.
(1)AgCl、Cu(OH)2、AgOH、Ag2CO3、CuCO3、BaCO3等物质都是难溶或微溶于水的物质,如先加入CO32-,则三种金属离子都生成沉淀,如先加入OH-离子,则会同时生成Cu(OH)2和AgOH沉淀,而先加入Cl-,则只生成AgCl沉淀,然后加入OH-,生成Cu(OH)2沉淀,最后加入CO32-,生成BaCO3沉淀,所以加入阴离子的顺序是Cl-、OH-、CO32-;
故答案为:Cl-、OH-、CO32-;
(2)硫酸铜溶于水形成蓝色溶液,而Ba(NO3)2、KCl、NaOH、Na2SO4溶于水形成无色溶液,所以加入适量蒸馏水,振荡试管,观察则可鉴别出CuSO4;
故答案为:CuSO4;
(3)化合价降低元素Cl所在的反应物氯酸钾是氧化剂,化合价降低的元素Cl所在的产物Cl2是还原产物Cl2;KClO3+6HCl═3Cl2+3H2O+KCl,元素化合价升高值等于元素化合价降低值=电子转移数=5,电子转移情况为: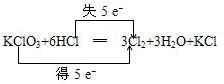 ;
;
故答案为:KClO3;Cl2; .
.
故答案为:Cl-、OH-、CO32-;
(2)硫酸铜溶于水形成蓝色溶液,而Ba(NO3)2、KCl、NaOH、Na2SO4溶于水形成无色溶液,所以加入适量蒸馏水,振荡试管,观察则可鉴别出CuSO4;
故答案为:CuSO4;
(3)化合价降低元素Cl所在的反应物氯酸钾是氧化剂,化合价降低的元素Cl所在的产物Cl2是还原产物Cl2;KClO3+6HCl═3Cl2+3H2O+KCl,元素化合价升高值等于元素化合价降低值=电子转移数=5,电子转移情况为:
 ;
;故答案为:KClO3;Cl2;
 .
.
练习册系列答案
相关题目