题目内容
(12分)A、B、C、D、E、F均为元素周期表前20号主族元素,其核电荷数依次增大。其中A、B同周期,B、D同主族且相邻,A、B、D三种元素的核电荷数之和为30。C、E同周期,可形成1:1型的离子化合物。F的最外层电子数大于1。请回答:
(1)A、B、C、D、E、F六种元素的元素符号分别为_______________________ __;
(2)用化学式表示A、D、E最高价氧化物的水化物酸性由强到弱的顺序:_______;
(3)用化学式表示D、E氢化物的还原性由强到弱的顺序:_______;
(4)请写出C、E最高价氧化物对应水化物之间反应的化学方程式:________________。
(1)A、B、C、D、E、F六种元素的元素符号分别为_______________________ __;
(2)用化学式表示A、D、E最高价氧化物的水化物酸性由强到弱的顺序:_______;
(3)用化学式表示D、E氢化物的还原性由强到弱的顺序:_______;
(4)请写出C、E最高价氧化物对应水化物之间反应的化学方程式:________________。
(共12分)(1)C、O、Na、S、Cl、Ca (各1分)(2)HClO4>H2SO4>H2CO3 (2分)(3)H2S> HCl(2分) (4)HClO4 + NaOH ==NaClO4 + H2O(2分)
B、D同主族且相邻,则B是第二周期,D是第三周期。C、E同周期,可形成1:1型的离子化合物,则该化合物应该是氯化钠或硫化镁。如果是硫化镁,则BD的原子序数之和就≤22,则A的原子序数最小是8,这和A的原子序数小于B的矛盾,所以C是钠,E是氯,则A是碳,B是氧元素,D是硫元素,F是钙。
(1)分别是C、O、Na、S、Cl、Ca。
(2)非金属性越强,最高价氧化物的水化物的酸性越强,非金属性是Cl>S>C,则酸性强弱顺序是HClO4>H2SO4>H2CO3。
(3)非金属性越强,相应氢化物的还原性越弱,所以还原性强弱顺序是H2S> HCl。
(4)C、E最高价氧化物对应水化物分别是强酸和强碱,方程式为HClO4 + NaOH ==NaClO4 + H2O。
(1)分别是C、O、Na、S、Cl、Ca。
(2)非金属性越强,最高价氧化物的水化物的酸性越强,非金属性是Cl>S>C,则酸性强弱顺序是HClO4>H2SO4>H2CO3。
(3)非金属性越强,相应氢化物的还原性越弱,所以还原性强弱顺序是H2S> HCl。
(4)C、E最高价氧化物对应水化物分别是强酸和强碱,方程式为HClO4 + NaOH ==NaClO4 + H2O。

练习册系列答案
相关题目
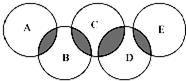
 .以下推断不正确的是( )
.以下推断不正确的是( ) 。下列说法正确的是( )
。下列说法正确的是( ) 、M
、M