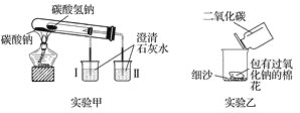
��Ŀ����
����Ŀ��ij��ѧ��ȤС����ͼ��װ���Ʊ�����������������һϵ��ʵ�顣
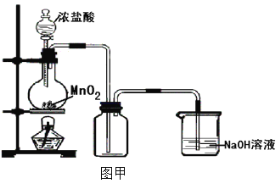
(1)ʵ�����Ʊ������ķ�Ӧԭ����_______________________
(2)����87gMnO2�μӷ�Ӧ,���������Ȼ�������ʵ���Ϊ____________����ʵ���ռ����������DZ�����ֵС����д������ܵ�һ��ԭ��____________
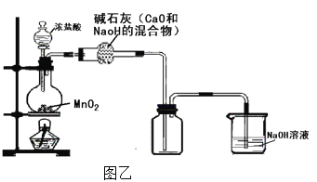
(3)��ͬѧ��Ϊͼ��װ���Ʊ������������������л���HCl�����ˮ��������װ�ý�������ͼ�ҸĽ�������Ϊ������____________ (���������롰���������֣��粻������������˵������)
(4)��ͼ��װ�ú�����װ����ȡ���ռ�һƿ�����������ȵ���˿�嵽���������ļ���ƿ�У�������˿�������м���ȼ�գ��ڼ���ƿ�ڳ�����ɫ���̣��̵ijɷ�Ϊ��Ӧ����ʽΪ____________
(5)���ռ�һƿ�������ڼ���ƿ�м���ˮ���۲쵽Һ��Ϊdz����ɫ���д������ԭ����____________������Һ�ֳ����ݣ��ֱ����һ-������������Һ��д����Ӧ�ķ���ʽ:
Na2CO3��Һ____________
AgNO3��Һ____________
KI��Һ____________
(6)��ʵ����������������ɢ���������У�����Ʒ����������____________
���𰸡�MnO2+4HCl(Ũ) ![]() MnCl2+Cl2��+2H2O 2mol HCl�ӷ���Cl2��������ˮ ���������������������Ʒ�Ӧ FeCl3��2Fe + 3Cl2
MnCl2+Cl2��+2H2O 2mol HCl�ӷ���Cl2��������ˮ ���������������������Ʒ�Ӧ FeCl3��2Fe + 3Cl2![]() 2FeCl3 Cl2 + H2O
2FeCl3 Cl2 + H2O ![]() HCl + HClO Na2CO3 + 2HCl = 2NaCl + CO2��+ H2O AgNO3 + HCl = AgCl��+ HNO3 2KI + Cl2 = KCl + I2 ��ʪ��⻯����ֽ����ʵ�����У�����ֽ������������������ɢ����������
HCl + HClO Na2CO3 + 2HCl = 2NaCl + CO2��+ H2O AgNO3 + HCl = AgCl��+ HNO3 2KI + Cl2 = KCl + I2 ��ʪ��⻯����ֽ����ʵ�����У�����ֽ������������������ɢ����������
��������
��1���������̺�Ũ�����ϼ��ȿ����Ʊ��������ݴ�д������ʽ��
��2��MnO2+4HCl(Ũ) ![]() MnCl2+Cl2��+2H2O��Ӧ�У���������HClΪ2mol������HCl��ӷ���������������ˮ���ᵼ����������С������ֵ��
MnCl2+Cl2��+2H2O��Ӧ�У���������HClΪ2mol������HCl��ӷ���������������ˮ���ᵼ����������С������ֵ��
��3����������������Ʒ�Ӧ��
��4����˿��������ȼ�������Ȼ�����
��5�������м���ˮ����ˮ������Ӧ���ɴ�������Ȼ��⣻��ˮ�к������ᣬ��̼������Һ����������Һ��Ӧ����ˮ�е���������⻯����Һ��Ӧ�����Ȼ��غ͵ⵥ�ʣ��ݴ�д������ʽ��
��6���������������ԣ��ܹ��ѵ����������ⵥ�ʣ�������������������ݴ����ʽ��������ļ��顣
��1��ʵ����ͨ���������̺�Ũ�����ϼ����Ƶ���������Ӧԭ����MnO2+4HCl(Ũ) ![]() MnCl2+Cl2��+2H2O��
MnCl2+Cl2��+2H2O��
��2��87gMnO2Ϊ1Ħ������������HClռ�μӷ�Ӧ��һ�룬���ݷ�Ӧ����ʽMnO2+4HCl(Ũ) ![]() MnCl2+Cl2��+2H2O��֪����������HClΪ2mol����Ӧ������HCl��ӷ�һ���ֵ�����������С������ֵ��Ҳ�п�����������������ˮ������ȷ���ǣ�2mol��HCl�ӷ���Cl2��������ˮ��
MnCl2+Cl2��+2H2O��֪����������HClΪ2mol����Ӧ������HCl��ӷ�һ���ֵ�����������С������ֵ��Ҳ�п�����������������ˮ������ȷ���ǣ�2mol��HCl�ӷ���Cl2��������ˮ��
��3������������Ϊ��������������Ʒ�Ӧ����������������һ���ֱ������������գ��ʴ��ǣ����������������������Ʒ�Ӧ
��4����˿��������ȼ�������Ȼ���������ʽΪ��2Fe + 3Cl2![]() 2FeCl3������ȷ���ǣ�FeCl3��2Fe + 3Cl2
2FeCl3������ȷ���ǣ�FeCl3��2Fe + 3Cl2![]() 2FeCl3��
2FeCl3��
��5�������м���ˮ����ˮ������Ӧ���ɴ�������Ȼ��⣬��Ӧ�Ļ�ѧ����ʽΪ��Cl2+H2OHCl+HClO����ˮ�ʻ���ɫ����ˮ�е��������̼������Һ��Ӧ�����Ȼ��ơ�ˮ�Ͷ�����̼����ѧ����ʽΪ��Na2CO3+2HCl=2NaCl+CO2��+H2O����ˮ�е����������������Һ��Ӧ�����Ȼ��������ᣬ��ѧ����ʽΪ��AgNO3+HCl=AgCl��+HNO3����ˮ�е���������⻯����Һ��Ӧ�����Ȼ��غ͵ⵥ�ʣ���ѧ����ʽΪ��2KI+Cl2=KCl+I2��
��6���������������ԣ��ܹ��ѵ����������ⵥ�ʣ��������������������ʪ��⻯����ֽ����ʵ�����У�����ֽ������������������ɢ���������С�

 �ŵ������ϵ�д�
�ŵ������ϵ�д�