题目内容
【题目】根据如图所示装置(部分仪器已略去)回答下列有关问题。
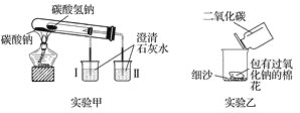
(1)实验甲在加热过程中能观察到产生白色沉淀的烧杯是________(填“Ⅰ”或“Ⅱ”),该烧杯中发生反应的离子方程式是________,通过实验甲可证明______(填“Na2CO3”或“NaHCO3”)更稳定。
(2)实验乙用来探究Na2O2与CO2的反应,观察到的实验现象为包有Na2O2的棉花着火。写出Na2O2与CO2反应的化学方程式:_________,棉花着火说明该反应的特点是_________
(3)取10 g碳酸钠和碳酸氢钠的混合物充分加热,将生成的CO2气体通入足量的澄清石灰水中,测得生成沉淀的质量为4.0 g。则原混合物中碳酸钠的质量分数为_________。
【答案】Ⅱ Ca2++2OH-+CO2===CaCO3↓+H2O Na2CO3 2Na2O2+2CO2===2Na2CO3+O2 放出大量的热 32.8%
【解析】
(1)碳酸氢钠不稳定,易分解成二氧化碳、碳酸钠和水,而碳酸钠不分解更加稳定,则甲图中可观察到与小试管相连的烧杯Ⅱ中变浑浊,该烧杯中发生反应的离子方程式是Ca2++2OH-+CO2===CaCO3↓+H2O,则由甲图可比较二者的热稳定性,故答案为:Ⅱ;Ca2++2OH-+CO2===CaCO3↓+H2O;Na2CO3;
(2)包有Na2O2的棉花着火燃烧,则Na2O2与CO2的反应为放热反应,且生成氧气,则该反应为2Na2O2+2CO2═2Na2CO3+O2,说明反应能放出大量的热;
(3)根据反应关系式:2NaHCO3~CO2~CaCO3,n(CaCO3)= ![]() =0.04mol,原混合物中碳酸氢钠的质量为:n(NaHCO3)= 2n(CaCO3)=0.08mol,m(NaHCO3)=nM=0.08mol×84g/mol=6.72g,原混合物中碳酸钠的质量分数为:w(Na2CO3)=
=0.04mol,原混合物中碳酸氢钠的质量为:n(NaHCO3)= 2n(CaCO3)=0.08mol,m(NaHCO3)=nM=0.08mol×84g/mol=6.72g,原混合物中碳酸钠的质量分数为:w(Na2CO3)=![]() ×100%=32.8%,故原混合物中碳酸钠的质量分数为32.8%。
×100%=32.8%,故原混合物中碳酸钠的质量分数为32.8%。

【题目】有a、b、c、d四个金属电极,有关的实验装置及部分实验现象如下:
实验装 置 |
|
|
|
|
部分实验现象 | a极质量减小;b极质量增加 | b极有气体产生;c极无变化 | d极溶解;c极有气体产生 | 电流从a极流向d极 |
由此可判断这四种金属的活动性顺序是( )
A.a>b>c>dB.b>c>d>aC.d>a>b>cD.a>b>d>c