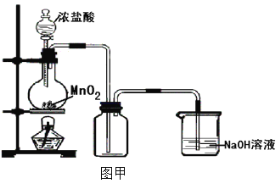
题目内容
【题目】回答下列问题
(1)配平以下方程式
__K2Cr2O7+__HC1=__KC1+__CrCl3+__H2O+__Cl2↑
(2)以上反应中失电子的物质是__,还原产物是__,每生成lmol这种还原产物,将有__mol电子发生转移。氧化剂与还原剂的物质的量之比为___。
(3)已知反应:2H2S+H2SO3=2H2O+3S↓,若氧化产物比还原产物多1.6g,则同时会生成水的质量为___g。
【答案】1 14 2 2 7 3 HCl CrCl3 3 1:6 1.8
【解析】
(1)分析反应中各元素化合价变化,依据氧化还原反应得失电子守恒,原子个数守恒配平方程式;
(2)反应物中所含元素化合价升高的为还原剂,对应氧化产物,所含元素化合价降低的反应物为氧化剂,对应还原产物;依据K2Cr2O7+14HCl(浓)=2KCl+2CrCl3+3Cl2↑+7H2O,可知生成3mol氯气转移6mol电子,被氧化的氯化氢物质的量为6mol;
(3)反应中H2S中S氧化化合价升高,SO2中S元素化合价降低,氧化产物为2mol,还原产物为1mol,此时氧化产物比还原产物多32g,据方程式计算。
(1)K2Cr2O7+HCl(浓)=KCl+CrCl3+Cl2↑+H2O,K2Cr2O7中+6价Cr化合价降为CrCl3中+3价,反应1molK2Cr2O7,得到6mol电子,HCl中-1价的Cl化合价升高为Cl2中的0价,生成1molCl2失去2mol电子,依据得失电子守恒可知:CrCl3系数为2,Cl2系数为3,然后根据反应前后各种原子个数相等配平,故方程式K2Cr2O7+14HC1=2KC1+2CrCl3+7H2O+3Cl2↑,故答案为:1;14;2;2;7;3;
(2)反应中K2Cr2O7中+6价Cr化合价降为CrCl3中+3价,所以K2Cr2O7为氧化剂,CrCl3为还原产物;HCl中-1价的Cl化合价升高为Cl2中的0价,所以HCl为还原剂,Cl2为氧化产物;依据
 ~6mole-
~6mole-
2 6
1 3
故电子转移3mol,从反应中得14HCl中有6HCl价态发生变化,还有8个未发生变化,故作还原剂的为6mol,氧化剂K2Cr2O7为1mol,故氧化剂与还原剂的物质的量之比为1:6,故答案为:HCl;CrCl3;3;1:6;
(3)反应2H2S+SO2=2H2O+3S↓中,生成3molS,氧化产物为2mol,还原产物为1mol,此时氧化产物比还原产物多32g,同时会生成水2mol,若氧化产物比还原产物多1.6g,同时会生成水0.1mol,质量是1.8g,故答案为:1.8。

 阅读快车系列答案
阅读快车系列答案