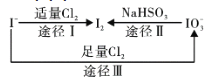
题目内容
【题目】实验室常用的几种气体发生装置如图A、B、C所示:

(1)实验室可以用B或C装置制取氨气,如果用C装置,通常使用的药品是_______;
(2)气体的性质是选择气体收集方法的主要依据。下列性质与收集方法无关的是______(填序号,下同)。
①密度 ②颜色 ③溶解性 ④热稳定性 ⑤与氧气反应
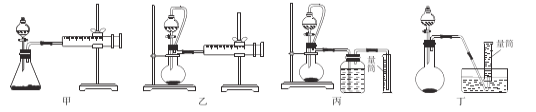
如图是某学生设计收集气体的几种装置,其中不可行的是________。

(3)若用A装置与D装置相连制取收集X气体,则X可能是下列气体中的_______。
①CO2 ②NO ③Cl2 ④H2
【答案】浓氨水、CaO固体(或Ca(OH)2或NaOH固体) ②④ b ③
【解析】
(1)实验室制取氨气常用铵盐与碱共热或向生石灰中加入浓氨水的方法;根据物质的存在状态、仪器的特点确定使用的试剂;
(2)收集气体方法的选择可依据气体的密度和溶解性,如气体与氧气反应,则只能用排水法收集;
(3)氯气有毒,不能直接排放到空气中,应有尾气吸收装置,NO不能用排空气法收集,氢气不能用向上排空气法收集,二氧化碳气体无需尾气吸收装置。
(1)装置B适用于固体或固体混合物加热制取氨气,使用试剂是铵盐与碱;若是使用装置C,根据图示可知应该是将浓氨水滴加到盛有CaO或Ca(OH)2或NaOH固体中,水被反应或被吸收,反应放出热量使一水合氨分解产生氨气,故通常使用的药品是浓氨水、CaO固体(或固体Ca(OH)2或NaOH固体);
(2)收集气体的方法的选择可依据气体的密度和溶解性,若气体与氧气反应,则只能用排水法收集;若气体密度比空气小,采用向下排空气方法收集;若气体密度比空气大,则采用向上排空气的方法收集;收集气体与气体是否有颜色无关,也与物质的稳定性无关,故合理选项是②④;对于密度比空气小的气体选用向下排空气方法收集时,使用d装置收集气体,导气管短进长出;若是收集的气体密度比空气大,使用向上排空气方法收集,可以使用a装置,也可以使用d装置,此时导气管是长进短出;对于难溶于水的气体,可用排水法收集,选用c装置进行收集;而b装置中气体进入不能排出集气瓶的空气,因此不能用于收集气体,故合理选项是b;
(3)若用A装置与D装置相连制取收集X气体,适用于固体、液体混合加热制备气体,气体不能和浓硫酸发生反应,且气体的密度比空气大,可以用向上排气法收集。
①CO2 制备不需要加热,CO2是空气的成分,无毒性,不需尾气吸收装置,①错误;
②NO可以制备但NO与O2会发生反应,不能使用排空气法收集,②错误;
③Cl2是采用固体和液体加热制备,可以用浓硫酸干燥,由于其密度比空气大,可以用向上排空气法收集,Cl2是有毒气体,要使用NaOH溶液进行尾气处理,③正确;
④H2制备不需要加热,且氢气的密度比空气小,不能用向上排空气法收集,④错误;
故合理选项是③。

【题目】硼氢化钠(NaBH4)是常用的还原剂,用途广泛。某探究小组采用偏硼酸钠(NaBO2)为主要原料制备NaBH4,其流程如下:
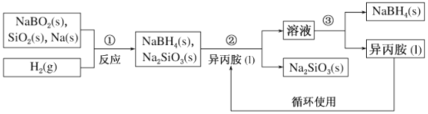
已知:NaBH4常温下易与水反应,可溶于异丙胺(沸点:33℃)
(1)在第①步反应加料之前,需要将反应器加热至 100 ℃以上并通入氩气 ,该操作的目的是______;第②步分离采用的方法是______;第③步分离NaBH4并回收溶剂,采用的方法是_____;
(2)NaBH4与水反应生成H2 : NaBH4 + 2H2O=NaBO2+4H2↑ (已知:HBO2是弱酸)。 实验测得,NaBH4每消耗一半所用的时间与溶液 pH、温度的关系如下表:
pH | 8 | 10 | 12 | 1 4 |
温度/℃ | 25 | 25 | 25 | 25 |
时间/ min | 6. 2 ×10-1 | 6. 2 ×10 | 6. 2 ×103 | 6. 2 ×105 |
①NaBH4与水反应开始释放H2很快 ,经过一段时间后就缓慢下来 ,可能原因一是反应物浓度降低 ;二是________;
②为了加快制取的H2速率,常将一些促进剂投入水中,下列物质中可作为促进剂的是__;
a. 碳酸钾 b. 稀硝酸 c 硫酸氢钠 d. 氨水
(3)利用如图所示装置,可以测定NaBH4与水反应生成 H2的速率,在pH =10、25℃条件下,将恒压滴液漏斗中NaBH4滴加到含有催化剂的三颈烧瓶中。
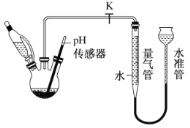
①实验中使用恒压滴液漏斗的原因为_________;
②气体生成结束后,水准管中的液面会高于量气管中的液面,此时量气管读数会_____( 填“偏大”或“偏小”)需要将水准管慢慢向下移动,则量气管中的液面会__________(填“上升”或“下降”);
③在此条件下,0. 38 g NaBH4开始反应至剩余 0. 19 g 时,实验测得量气管内气体体积为124mL,则这段时间内,生成H2的平均速率是_______mL·min-1。