��Ŀ����
����Ŀ���ʻ���COS���㷺Ӧ����ũҩ��ҽҩ���������������С�
��1��������Ԫ��λ��ͬһ���壬��ԭ�ӽṹ�Ĺ�ͬ����______���ʻ����к��еĻ�ѧ��������______��
��2��CO��H2S��ϼ��������ʻ���ķ�Ӧ��CO(g) �� H2S(g) ![]() COS(g) �� H2(g)��
COS(g) �� H2(g)��
��ش��������⡣
��ij�¶��£���1L�����ܱ������У�����10mol CO��10mol H2S��ƽ��ʱ���COת����Ϊ40%������¶��·�Ӧ��ƽ�ⳣ��K=______��
������ͼ�����÷�Ӧ��_______��Ӧ������ȡ����ȡ�����
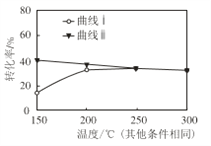

���������ͼ250����ǰ, ���� �� �仯�Ŀ���ԭ����_________��
���𰸡� ������������ͬ ���ۼ������Թ��ۼ������Լ��� 4/9 ���� �¶����ߣ���Ӧ���ʼӿ죨����ʼʱ��Ӧ���Ũ�ȴ�
����������1��ͬ����Ԫ�أ�ԭ�ӽṹ�Ĺ�ͬ�ص�Ϊ��������������ͬ��COS��C��O�������Ե��ӣ�C��S�������Ե��ӣ�C=S��C=O��Ϊ���Թ��ۼ�����COS�к��еĻ�ѧ������Ϊ���ۼ������Թ��ۼ������Լ�����
��2����ƽ��ʱCOת����Ϊ40%�����n(CO)=4mol����c(CO)=4mol/L��������֪��Ϣ���г��÷�Ӧ������ʽ��
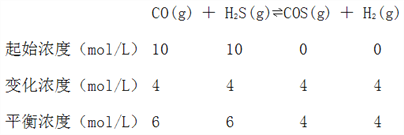
K=![]() =
=![]() =
=![]() ��
��
�ڸ�������ii��֪�������¶ȵ����ߣ�H2S��ƽ��ת�������¶����߶����ͣ�������ӦΪ���ȷ�Ӧ��
������iΪ��ͬʱ���ڲ�ͬ�¶���H2S��ת���ʣ�250��ǰ��Ӧ���ʽ�����һ��ʱ����δ�ﵽƽ�⣬��ת�����뷴Ӧ���ʴ�С�йء��¶����ߣ���Ӧ���ʼӿ죬ת��������

 һ��һ����ʱ���ϵ�д�
һ��һ����ʱ���ϵ�д�����Ŀ������̿�ɴ���������Ⱦ��NO��Ϊģ��ù��̣�T��ʱ����3L�ܱ������м���NO�ͻ���̿�ۣ���Ӧ��ϵ�и����ʵ����仯���±���ʾ������˵����ȷ����
����̿/mol | NO/mol | X/mol | Y/mol | |
��ʼʱ | 2.030 | 0.100 | 0 | 0 |
10min��ƽ�� | 2.000 | 0.040 | 0.030 | 0.030 |
A. Xһ����N2��Yһ����CO2
B. 10min������ѹǿ��NO������������
C. 10min��������̿��ƽ��������Ӧ�����ƶ�
D. 0~10min��ƽ����Ӧ����v(NO)=0.002 mol/(Lmin)

