题目内容
9.下列关于氨的合成与催化剂的说法中正确的是( )| A. | 当断裂3mol H-H键的同时断裂2mol N-H键时,达到了化学平衡状态 | |
| B. | 加入催化剂,能同等程度的增大合成氨的正、逆反应速率 | |
| C. | 工业合成氨采用高压,压强越高越有利于提高经济效益 | |
| D. | 增加催化剂的用量,可以增大氢气的转化率 |
分析 A.根据平衡时正逆反应速率相等判断;
B.催化剂只改变反应速率,不改变平衡移动;
C.增大压强对设备有更高的要求;
D.催化剂只改变反应速率,不改变平衡移动.
解答 解:A、反应方程式为N2+3H2$?_{高温高压}^{催化剂}$NH3,由方程式可知,当断裂3mol H-H键的同时断裂6mol N-H键时,达到化学平衡状态,故A错误;
B、催化剂只改变反应速率,不改变平衡移动,所以催化剂,能同等程度的增大合成氨的正、逆反应速率,故B正确;
C、增大压强对设备有更高的要求,且消耗能源,不利于提高经济效益,故C错误;
D、催化剂只改变反应速率,不改变平衡移动,所以增加催化剂的用量,氢气的转化率不变,故D错误;
故选B.
点评 本题考查化学平衡的调控作用,侧重于学生的分析能力和自学能力的考查,为高考常见题型和高频考点,注意把握化学平衡移动原理对工业生成的指导意义,学习中注意相关基础知识的学习和理解,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
20.下列叙述中,不符合生产实际的是( )
| A. | 在镀件上镀锌,用锌做阳极 | |
| B. | 电解饱和食盐水,碳网做阴极 | |
| C. | 电解熔融的氯化铝制取金属铝,用铁做阳极 | |
| D. | 电解法精制铜,用纯铜做阴极 |
17.现有0.05mol•L-1 CH3COOH溶液500mL,若加500mL水或加入部分CH3COONa晶体时,都会引起( )
| A. | 溶液的pH增大 | B. | CH3COOH的电离程度增大 | ||
| C. | 溶液的导电能力减小 | D. | 溶液的c (OH-)减小 |
4.进入秋冬季节后,雾霾这种环境污染问题逐渐凸显.从物质分类来看雾霾属于胶体,它区别于溶液等其它分散系的本质特征是( )
| A. | 产生丁达尔现象 | B. | 胶体是混合物 | ||
| C. | 分散质粒子直径在1nm~100nm之间 | D. | 胶体的分散剂为气体 |
14.在一个体积为1L的容器中,充入2mol CO和2mol H2O,一段时间后反应CO(g)+H2O(g)?CO2(g)+H2(g)在密闭容器中达到了平衡状态.平衡后c(CO2)=1.2mol•L-1,则该温度下此反应的平衡常数K为( )
| A. | 1.25 | B. | 2 | C. | 2.25 | D. | 3.2 |
18.下列说法正确的是( )
| A. | 已知:H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8 kJ•mol-1,则H2的燃烧热为-285.8 kJ•mol-1 | |
| B. | 已知:S(g)+O2(g)═SO2(g)△H1=-Q1;S(s)+O2(g)═SO2(g)△H2=-Q2,则Q1<Q2 | |
| C. | 已知:$\frac{1}{2}$H2SO4(浓)+NaOH(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H1;CH3COOH(aq)+NH3•H2O(aq)═CH3COONH4(aq)+H2O(l)△H2,则有|△H1|<|△H2| | |
| D. | 已知:Fe2O3(s)+3C(石墨)═2Fe(s)+3CO(g)△H=+489.0 kJ•mol-1 CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283.0 kJ•mol-1 C(石墨)+O2(g)═CO2(g)△H=-393.5 kJ•mol-1 则4Fe(s)+3O2(g)═2Fe2O3(s)△H=-1 641.0 kJ•mol-1 |
19.下列有关0.2mol•L-1 BaCl2溶液的说法正确的是( )
| A. | 1L溶液中Cl-离子浓度为0.2mol•L-1 | |
| B. | 1L溶液中Cl-离子总数为0.2NA | |
| C. | 1L溶液中Ba2+离子浓度为0.2mol•L-1 | |
| D. | 1L溶液中Ba2+和Cl-离子总数为0.4NA |
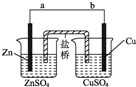 某学生利用如图实验装置探究盐桥式原电池的工作原理
某学生利用如图实验装置探究盐桥式原电池的工作原理