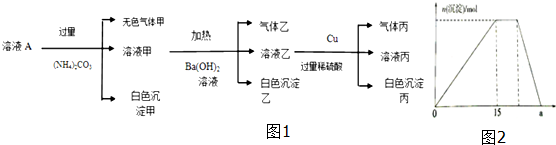
题目内容
19.同温同压下,等质量的氧气和臭氧,体积比为3:2,密度比为2:3.标准状况下,16g氧气和臭氧的混合气体体积为8.96L,则氧气的体积为4.48L.分析 根据n=$\frac{m}{M}$计算物质的量之比,同温同压下,气体体积之比等于其物质的量之比,密度之比等于相对分子质量之比;
根据v=$\frac{V}{{V}_{m}}$计算混合气体物质的量,结合总质量列方程计算各自物质的量,再根据V=nVm计算氧气体积.
解答 解:根据n=$\frac{m}{M}$可知,等质量的氧气和臭氧的物质的量之比=48g/mol:32g/mol=3:2,同温同压下,气体体积之比等于其物质的量之比,故二者体积之比为3:2,同温同压下,气体密度之比等于相对分子质量之比,故二者密度之比为32:48=2:3;
混合气体总物质的量为$\frac{8.96L}{22.4L/mol}$=0.4mol,设氧气、臭氧物质的量分别为xmol、ymol,则:
$\left\{\begin{array}{l}{x+y=0.4}\\{32x+48y=16}\end{array}\right.$
解得x=y=0.2
故标况下,氧气体积为0.2mol×22.4L/mol=4.48L,
故答案为:3:2;2:3;4.48.
点评 本题考查物质的量有关计算,比较基础,注意掌握以物质的量为中心的计算,有利于基础知识的巩固.

练习册系列答案
相关题目
9.下列关于各图的叙述中正确的是( )


| A. | 图甲表示lmol H2(g)完全燃烧生成水蒸气吸收241.8kJ热量 | |
| B. | 图甲表示2mol H2(g)所具有的能量比2mol H2O(g)所具有的能量多483.6kJ | |
| C. | 图乙表示常温下稀释HA、HB两种酸的图象,得出结论:HA的酸性大于HB的酸性 | |
| D. | 图乙中起始时HA的物质的量浓度大于HB |
14.对四组无色透明的强酸性溶液进行离子检验,四位同学各鉴定一组,他们实验报告的结论如下,其中可能正确的是( )
| A. | Na+、Ba2+、Cl-、NO${\;}_{3}^{-}$ | B. | Ca2+、NO${\;}_{3}^{-}$、HCO3-、Cl- | ||
| C. | K+、OH-、Cl-、SO42- | D. | MnO${\;}_{4}^{-}$、K+、S2-、Na+ |
4.对于溶液中某些离子的检验及结论一定正确的是( )
| A. | 加入足量稀盐酸无沉淀,再加入氯化钡溶液后有白色沉淀产生,一定有SO42- | |
| B. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- | |
| C. | 无色试液加入NaOH溶液,试管口湿润的红色石蕊试纸未变蓝,结论:试液中无NH4+ | |
| D. | 无色溶液中加入稀盐酸产生无色气体,该气体能使澄清石灰水变浑浊,结论:原溶液一定含有CO32- |
11.下列有关实验室制取气体的反应中,其原理不属于氧化还原反应的是( )
| A. | 实验室中铁和稀盐酸反应制取H2 | |
| B. | 实验室中用大理石和盐酸反应制取CO2 | |
| C. | 实验室中用氯酸钾加热分解制取 O2 | |
| D. | 实验室中用H2O2与MnO2混合制取O2 |
8.下列关于电离能和电负性的说法不正确的是( )
| A. | 第一电离能的大小:Mg>Al | |
| B. | 锗的第一电离能高于碳而电负性低于碳 | |
| C. | 前四周期的元素,核外电子中未成对的电子个数最多可以达到6个 | |
| D. | F、K、Fe、Ni四种元素中电负性最大的是F |
9.下列关于氨的合成与催化剂的说法中正确的是( )
| A. | 当断裂3mol H-H键的同时断裂2mol N-H键时,达到了化学平衡状态 | |
| B. | 加入催化剂,能同等程度的增大合成氨的正、逆反应速率 | |
| C. | 工业合成氨采用高压,压强越高越有利于提高经济效益 | |
| D. | 增加催化剂的用量,可以增大氢气的转化率 |
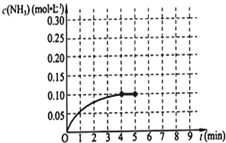 在一固定容积为2L的密闭容器内加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g),△H<0.反应中NH3的物质的量浓度的变化情况如图所示,请回答下列问题:
在一固定容积为2L的密闭容器内加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g),△H<0.反应中NH3的物质的量浓度的变化情况如图所示,请回答下列问题: