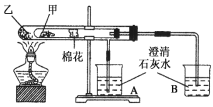
题目内容
【题目】在Al2(SO4)3和MgSO4的混合液中滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如图所示,则原溶液中Al2(SO4)3和MgSO4的物质的量之比为( )
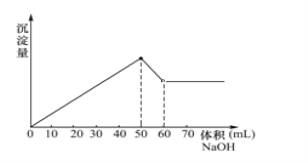
A. 1 : 1B. 3 : 1C. 3 : 2D. 1 :2
【答案】D
【解析】
在Al2(SO4)3和MgSO4的混合液中滴加NaOH溶液,先发生Mg2+、Al3+和OH-的沉淀反应:Mg2++2OH-=Mg(OH)2↓,Al3++3OH-=Al(OH)3↓,继续滴加NaOH溶液,生成的Al(OH)3被NaOH溶解:Al(OH)3+NaOH=NaAlO2+2H2O。
溶解Al(OH)3需要的NaOH溶液的体积为10mL,假设NaOH的浓度为1mol/L,即0.01molNaOH和Al(OH)3反应,那么Al(OH)3为0.01mol,根据铝守恒,Al3+为0.01mol,0.01molAl3+消耗0.03molOH-生成沉淀。生成Al(OH)3和Mg(OH)2共消耗NaOH0.05mol,所以Mg2+消耗的NaOH为0.02mol,那么Mg2+为0.01mol,所以MgSO4为0.01mol,Al3+是0.01mol,那么Al2(SO4)3为0.005mol,所以Al2(SO4)3和MgSO4的物质的量之比为1:2。
故选D。

练习册系列答案
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案
相关题目