题目内容
 有A、B、C、D四种短周期元素,其原子序数依次增大.A、B可形成A2B和A2B2两种化合物,B、C同主族且可形成CB2和CB3两种化合物.回答下列问题.
有A、B、C、D四种短周期元素,其原子序数依次增大.A、B可形成A2B和A2B2两种化合物,B、C同主族且可形成CB2和CB3两种化合物.回答下列问题.(1)A2B2的电子式为


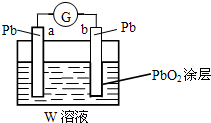
(2)CB2通入A2B2溶液中可被氧化为W,用W的溶液(体积为1L,假设变化前后溶液体积变化忽略不计)组装成原电池(如图所示).在b电极上发生的反应可表示为:PbO2+4H++SO42-+2e-=PbSO4+2H2O,则在a电极上发生的反应可表示为
Pb-2e-+SO42-=PbSO4
Pb-2e-+SO42-=PbSO4
.(3)金属元素E是中学化学常见元素,位于元素周期表的第四周期.该元素可与D形成ED2和ED3两种化合物.将E的单质浸入ED3溶液中(如图甲所示),溶液由黄色逐渐变为浅绿色,该反应的离子方程式为
Fe+2Fe3+=3Fe2+
Fe+2Fe3+=3Fe2+
.
(4)依据(3)中的反应,可用单质E和石墨为电极设计一个原电池,则在该原电池工作时,石墨一极发生的反应可以表示为
2Fe3++2e-=2Fe2+
2Fe3++2e-=2Fe2+
.比较甲、乙两图,说明石墨除形成闭合回路外所起的作用是使还原反应和氧化反应在电解质溶液中的不同区域内发生
使还原反应和氧化反应在电解质溶液中的不同区域内发生
.分析:A、B可形成A2B和A2B2两种化合物,可能为H2O、H2O2或Na2O、Na2O2,A、B、C、D四种短周期元素,其原子序数依次增大,则A为H元素,B为O元素,B、C同主族且可形成CB2和CB3两种化合物,应为SO2和SO3,则C为S元素,D应为Cl元素,
(1)A2B2为H2O2,为共价化合物;
(2)CB2通入A2B2溶液中可被氧化为W,则w为H2SO4,形成铅蓄电池;
(3)金属元素E是中学化学常见元素,位于元素周期表的第四周期.该元素可与D形成ED2和ED3两种化合物,则E为Fe元素;
(4)石墨--铁在氯化铁电解质溶液中形成原电池.
(1)A2B2为H2O2,为共价化合物;
(2)CB2通入A2B2溶液中可被氧化为W,则w为H2SO4,形成铅蓄电池;
(3)金属元素E是中学化学常见元素,位于元素周期表的第四周期.该元素可与D形成ED2和ED3两种化合物,则E为Fe元素;
(4)石墨--铁在氯化铁电解质溶液中形成原电池.
解答:解:A、B可形成A2B和A2B2两种化合物,可能为H2O、H2O2或Na2O、Na2O2,A、B、C、D四种短周期元素,其原子序数依次增大,则A为H元素,B为O元素,B、C同主族且可形成CB2和CB3两种化合物,应为SO2和SO3,则C为S元素,D应为Cl元素.
(1)A2B2为H2O2,为共价化合物,电子式为 ,故答案为:
,故答案为: ;
;
(2)CB2通入A2B2溶液中可被氧化为W,则w为H2SO4,形成铅蓄电池,负极反应为Pb-2e-+SO42-=PbSO4,
故答案为:Pb-2e-+SO42-=PbSO4;
(3)金属元素E是中学化学常见元素,位于元素周期表的第四周期.该元素可与D形成ED2和ED3两种化合物,则E为Fe元素,将Fe浸入到FeCl3中,发生反应为Fe+2Fe3+=3Fe2+,溶液由黄色逐渐变为浅绿色,
故答案为:Fe+2Fe3+=3Fe2+;
(4)石墨--铁在氯化铁电解质溶液中形成原电池,铁做负极,发生反应为Fe-2e-=Fe2+,在正极上得电子被还原,发生反应为2Fe3++2e-=2Fe2+,氧化反应和还原反应分别在不同极上发生.
故答案为:2Fe3++2e-=2Fe2+;使还原反应和氧化反应在电解质溶液中的不同区域内发生.
(1)A2B2为H2O2,为共价化合物,电子式为
 ,故答案为:
,故答案为: ;
;(2)CB2通入A2B2溶液中可被氧化为W,则w为H2SO4,形成铅蓄电池,负极反应为Pb-2e-+SO42-=PbSO4,
故答案为:Pb-2e-+SO42-=PbSO4;
(3)金属元素E是中学化学常见元素,位于元素周期表的第四周期.该元素可与D形成ED2和ED3两种化合物,则E为Fe元素,将Fe浸入到FeCl3中,发生反应为Fe+2Fe3+=3Fe2+,溶液由黄色逐渐变为浅绿色,
故答案为:Fe+2Fe3+=3Fe2+;
(4)石墨--铁在氯化铁电解质溶液中形成原电池,铁做负极,发生反应为Fe-2e-=Fe2+,在正极上得电子被还原,发生反应为2Fe3++2e-=2Fe2+,氧化反应和还原反应分别在不同极上发生.
故答案为:2Fe3++2e-=2Fe2+;使还原反应和氧化反应在电解质溶液中的不同区域内发生.
点评:本题考查元素推断和电化学知识,考查较为综合,题目难度中等,注意正确推断元素的种类为解答该题的关键.

练习册系列答案
相关题目




