题目内容
【题目】下列实验能获得成功的是( )
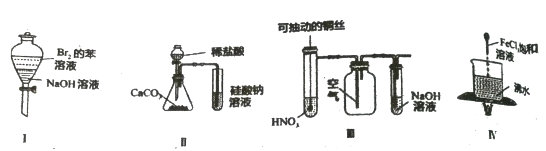
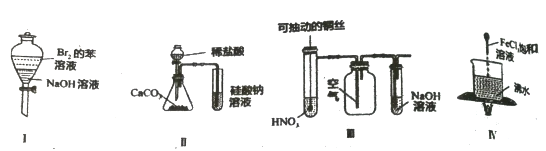
A. 苯和浓溴水混合加入铁作催化剂制溴苯
B. 将苯和浓硝酸混合共热制硝基苯
C. 乙烷与氯气光照制取纯净的一氯乙烷
D. 乙烯通入溴的四氯化碳溶液中获得1,2-二溴乙烷
【答案】D
【解析】
A.苯和液溴在铁作催化剂的条件下能发生取代反应,和溴水不反应,故A错误;
B.苯和硝酸在浓硫酸作催化剂、加热的条件下能发生取代反应,故B错误;
C.乙烷和氯气反应取代反应不仅生成一氯乙烷还生成其它卤代烃,故C错误;
D.乙烯中含有碳碳双键,性质较活泼,能和溴水发生加成反应生成l,2﹣二溴乙烷,故D正确;
故答案为D。

 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案【题目】铁是生产生活中应用最广泛的金属,炼铁技术备受关注,己知:
①2Fe2O3(s)+3C(s)![]() 4Fe(s)+3CO2(g) △H=+460.5kJ/mol
4Fe(s)+3CO2(g) △H=+460.5kJ/mol
②Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g) △H=-28.5kJ/mol
2Fe(s)+3CO2(g) △H=-28.5kJ/mol
③ 断裂lmol CO(s)气体中的化学键需要吸收1O76kJ的能量
断裂lmolCO2(s)气体中的化学键需要吸收1490kJ的能量
请回答下列问题:
(l)断裂1molC(s)中所有化学键需要吸收的能量为_________。
(2)T1℃时,向密闭容器中加入一定量的Fe2O3和C,发生反应①,达到平衡后,CO2的浓度为a mol/L;其他条件不变,缩小容器容积,再次达到平衡时,CO2的浓度为bmol/L,则a____b (选填“>”“<”或“=”)。
(3)起始温度均为T2℃时,向容积为10L的三个恒容密闭容器中,分别加入一定量的Fe2O3和CO发生反应②,测得相关数据如表所示:
编号 | 容器 | 起始时物质的量/mol | 平衡时物质的量/mol | 平衡常数(K) | |
Fe2O3 | CO | Fe | |||
1 | 恒温 | 0.5 | 1.5 | 0.8 | K1 |
2 | 恒温 | 2 | 3 | m | K2 |
3 | 绝热 | 1 | 1.5 | n | K3 |
①T2℃时,容器1中反应的平衡常数Kl=_______。
②容器2中,5min达到平衡,则0~5min内以CO2表示该反应的速率v(CO2)=_____。
③对于三个容器中的反应,下列说法正确的是(填选项字母)________。
A.m>2n B. 容器1和容器2中CO的平衡转化率al<a2
C. K1=K3 D. 平衡时气体压强:P3>Pl
(4)T2℃时,向恒压密闭容器中充入0.5molFe2O3和1.0molCO,发生反应② ,CO和CO2的物质的量浓度(c)与时间(t)的关系如图所示。
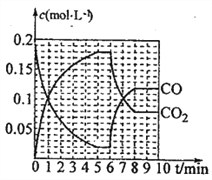
6min时,改变的外界条件为_________,理由为___________。