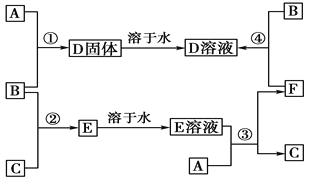
题目内容
【题目】下列实验现象预测正确的是
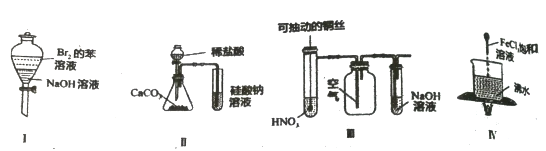
A. 实验I:振荡后静置,上层溶液颜色保持不变
B. 实验II:试管溶液中中出现气泡,溶液先出现浑浊后变澄清
C. 实验III:微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终保持无色
D. 实验IV:加热至混合液呈红褐色,停止加热,该分散系产生丁达尔效应
【答案】D
【解析】A.溴和氢氧化钠溶液反应,苯层无色,故A错误;B.稀盐酸有挥发性,生成的CO2中混有HCl气体,硅酸钠溶液中通入HCl气体也能出现白色沉淀,则无法证明碳酸的酸性比硅酸强,故B错误;C.反应生成的NO与空气中的氧气反应,则广口瓶内气体为红棕色,故C错误;D.煮沸溶液至红褐色,生成胶体,当光束通过体系时可产生丁达尔效应,故正确;故答案为D。

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案【题目】工业合成氨缓解了有限耕地与不断增长的人口对粮食大量需求之间的矛盾。
(1)N2分子通常条件下非常稳定,其本质原因是____________________,工业上选择500℃主要出于两方面考虑,一是__________,二是__________。
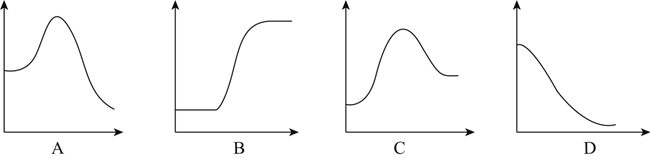
(2)将1mol气态分子断裂成气态原子所吸收的能量叫键能。相关键能数据如下表:
共价键 | H-H | N≡N | N-H |
键能(kJ/mol) | 436 | 946 | 391 |
结合表中所给信息,下图中能正确表示合成氨反应过程中能量变化关系的是__________。
(3)一定条件下,氨与水的反应存在限度,氨水成弱碱性,用一个化学用语,表示氨与水反应及溶液显碱性的原因____________________。
(4)硫酸铵是一种固态氮肥,俗称“肥田粉”。硫酸铵可由氨与硫酸反应生成,硫酸铵中含有的化学键类型有______________________________。
(5)氨氧化法可以用来生产硝酸,写出第一步和第三步的化学反应方程式____________________、____________________。