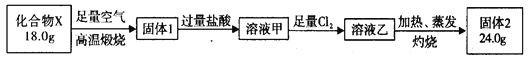
题目内容
【题目】(1)甲醇燃料电池(DNFC)被认为是21世纪电动汽车最佳候选动力源。
①在25℃、101kPa下,1g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为__________________________。
②甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
a.CH3OH(g)+H2O(g) ![]() CO2(g)+3H2(g) △H1=+49.0kJ·mol—1
CO2(g)+3H2(g) △H1=+49.0kJ·mol—1
b. ![]() △H2
△H2
已知H2(g)+ ![]() O2(g)
O2(g) ![]() H2O(g) △H3=-241.8kJ·mol-1
H2O(g) △H3=-241.8kJ·mol-1
则反应②的△H2=_________ kJ·mol-1。
(2)工业上一般可采用下列反应来合成甲醇:CO(g)+2H2(g)CH3OH(g),现实验室模拟该反应并进行分析,图1是该反应在不同温度下CO的转化率随时间变化的曲线。
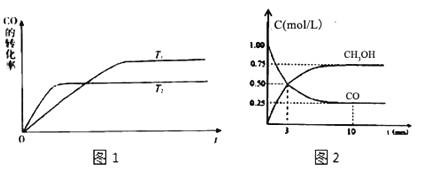
①该反应的焓变△H_____0(填“>”“<”或“=”).
②T1和T2温度下的平衡常数大小关系是K1_____K2(填“>”“<”或“=”)
③现进行如下实验,在体积为1L的密闭容器中,充入1molCO和3molH2,测得CO和CH3OH(g)的浓度随时间变化如图2所示.从反应开始到平衡,CO的平均反应速率v(CO)=_____,该反应的平衡常数为K=_____。
④恒容条件下,达到平衡后,下列措施中能使![]() 增大的有_____。
增大的有_____。
A.升高温度 B.充入He(g)
C.再充入1molCO 和3molH2 D.使用催化剂.
【答案】 CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) ΔH=–725.76kJ·mol-1 -192.8 < > 0.075mol/(Lmin)
O2(g)=CO2(g)+2H2O(l) ΔH=–725.76kJ·mol-1 -192.8 < > 0.075mol/(Lmin) ![]() C
C
【解析】(1)①1g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68kJ,则1mol甲醇(32g) 燃烧生成CO2和液态水时放热32×22.68kJ=725.76kJ,故甲醇燃烧的热化学方程式为CH3OH(l)+ ![]() O2(g)=CO2(g)+2H2O(l) ΔH=–725.76kJ·mol-1;②根据盖斯定律可知,a-b即得到H2 (g)+
O2(g)=CO2(g)+2H2O(l) ΔH=–725.76kJ·mol-1;②根据盖斯定律可知,a-b即得到H2 (g)+ ![]() O2 (g)=H2O(g),所以该反应的△H3=△H2-△H1,即-241.8kJ·mol-1=△H2-49.0kJ·mol—1,.解得△H2 =-192.8 kJ·mol -1;(2)①根据先拐先平原则,由图1可知,温度T1<T2,平衡时,温度越高CO的转化率越小,说明升高温度,平衡向逆反应移动,升高温度平衡向吸热反应移动,故该反应正反应为放热反应,△H<0;②平衡时,温度越高CO的转化率越小,说明升高温度,平衡向逆反应移动,升高温度平衡向吸热反应移动,故该反应正反应为放热反应;升高温度,平衡向逆反应移动,所以K1>K2;③CO的平均反应速率v(CO)=
O2 (g)=H2O(g),所以该反应的△H3=△H2-△H1,即-241.8kJ·mol-1=△H2-49.0kJ·mol—1,.解得△H2 =-192.8 kJ·mol -1;(2)①根据先拐先平原则,由图1可知,温度T1<T2,平衡时,温度越高CO的转化率越小,说明升高温度,平衡向逆反应移动,升高温度平衡向吸热反应移动,故该反应正反应为放热反应,△H<0;②平衡时,温度越高CO的转化率越小,说明升高温度,平衡向逆反应移动,升高温度平衡向吸热反应移动,故该反应正反应为放热反应;升高温度,平衡向逆反应移动,所以K1>K2;③CO的平均反应速率v(CO)=![]() =0.075mol/(Lmin);
=0.075mol/(Lmin);
根据反应方程式:CO + 2H2 CH3OH
起始(mol/L) 1 3 0
反应(mol/L) 0.75 1.5 0.75
平衡 (mol/L) 0.25 1.5 0.75
反应的平衡常数K=![]() =
=![]() ;④因该反应为放热反应,升高温度平衡将向逆反应方向移动,
;④因该反应为放热反应,升高温度平衡将向逆反应方向移动, ![]() 将减小,选项A错误;恒容条件下,充入He,平衡不移动,
将减小,选项A错误;恒容条件下,充入He,平衡不移动, ![]() 将保持不变,选项B错误;再充入1molCO和3mol H2 相当于增大了压强,平衡将向正反应方向移动,
将保持不变,选项B错误;再充入1molCO和3mol H2 相当于增大了压强,平衡将向正反应方向移动, ![]() 将增大,选项C正确;使用催化剂,平衡不移动,
将增大,选项C正确;使用催化剂,平衡不移动, ![]() 仍将保持不变,选项D错误,答案选C。
仍将保持不变,选项D错误,答案选C。

 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案