题目内容
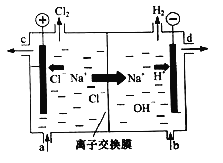
【题目】海水中含有丰富的Na+、Mg2+、Cl﹣、Br﹣等化学资源。以浓缩海水为原料,通过一系列工艺流程可以提取Mg、Br2等产品。
(1)从海水中提取镁的主要步骤如下:

①操作a的名称是______。
②A与试剂X反应的离子方程式是______。
(2)空气吹出法是用于工业规模海水提溴的常用方法,其中一种工艺是以预先经过酸化的浓缩海水为原料,通过以下步骤提取溴。步骤Ⅰ:用氯气置换溴离子使之成为单质溴;步骤Ⅱ:通入空气和水蒸气,将溴吹入吸收塔,使溴蒸气和吸收剂SO2发生作用转化 成氢溴酸;步骤Ⅲ:用氯气将氢溴酸氧化得到产品溴。
①下列说法正确的是______(填序号)。
a.步骤Ⅰ和步骤Ⅱ的目的是使溴富集
b.上述步骤中的反应可说明氧化性:Cl2>Br2
c.步骤Ⅰ和步骤Ⅲ发生的主要反应的原理不同
②若在步骤Ⅱ中消耗的SO2的质量为6.4×103 g,则上述过程中理论上消耗的氯气的体积在标准状况下至少是______ L。
【答案】 过滤 Mg(OH)2+2H+=Mg2++2H2O ab 4.48×103
【解析】①石灰水与镁离子反应生成氢氧化镁沉淀,过滤得到,因此操作a的名称是过滤;②A是氢氧化镁,与盐酸反应生成氯化镁和水,则A与试剂X反应的离子方程式是Mg(OH)2+2H+=Mg2++2H2O。(2)①a. ①用氯气置换溴离子使之成为单质溴,通入空气和水蒸气,将溴吹入吸收塔,使溴蒸气和吸收剂SO2发生作用转化成氢溴酸,步骤一和步骤二的目的是富集溴,a正确;b.氯气能把溴离子氧化为单质溴,这说明氧化性:Cl2>Br2,b正确;c.步骤Ⅰ和步骤Ⅲ发生的主要反应的原理相同,均是氯气氧化溴离子为单质溴,c错误;答案选ab;②二氧化硫的物质的量是6400g÷64g/mol=100mol,失去电子的物质的量是200mol,根据电子转移守恒可知两次消耗氯气的物质的量均是100mol,共计是200mol,在标准状况下的体积是4480L。

 孟建平名校考卷系列答案
孟建平名校考卷系列答案【题目】有A、B、C、D四种强电解质,它们在水中电离产生下列离子(每种物质只含一种阴离子且互不重复)。
阳离子 | Na+、Ba2+、NH |
阴离子 | CH3COO-、OH-、Cl-、SO |
已知:①A、C溶液的pH均大于7,A、B的溶液中水的电离程度相同;②C溶液和D溶液相遇时只生成白色沉淀,B溶液和C溶液相遇时只生成刺激性气味的气体,A溶液和D溶液混合时无现象。
(1)A是__________,B是____________(填化学式) 。
(2)写出C和D反应的离子方程式________________。
(3)25 ℃时,0.1 mol·L-1 B溶液的pH=a,则B溶液中c(H+)-c(NH3·H2O)=____________________(用含有a的关系式表示)。
(4)将等体积、等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序是________________。
(5)在一定体积的0.005 mol·L-1的C溶液中,加入一定体积的0.00125 mol·L-1的盐酸,混合溶液的pH=11,若反应后溶液的体积等于C溶液与盐酸的体积之和,则C溶液与盐酸的体积比是______。