题目内容
【题目】厨房垃圾发酵液可通过电渗析法处理,同时得到乳酸的原理如图所示 (图中 HA 表示乳酸分子,A - 表示乳酸根离子) 。下列说法正确的是( )
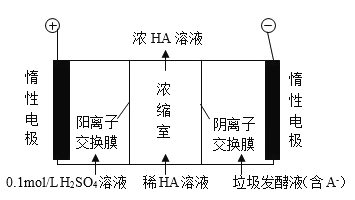
A.通电后,阳极附近 pH 增大
B.电子从负极经电解质溶液回到正极
C.当电路中通过 2mol 电子的电量时,会有 1mol 的 O2 生成
D.通电后, A- 通过阴离子交换膜从阴极进入浓缩室
【答案】D
【解析】
A.氢氧根离子在阳极上失电子发生氧化反应,氢离子浓度增大,pH减小,故A错误;
B.电子不能通过溶液,故B错误;
C.阳极反应式4OH--4e-═2H2O+O2↑,所以当电路中通过2mol电子的电量时,会有0.5mol的O2生成,故C错误;
D.阳极OH-放电,c(H+)增大,H+从阳极通过阳离子交换膜进入浓缩室,则A-通过阴离子交换膜从阴极进入浓缩室,故D正确;
答案选D。

 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案【题目】Co3O4是制备石墨烯电池正极材料LiCoO2的原料。以钴矿石(主要成分为Co3S4,含有少量FeO、Fe2O3、Al2O3等杂质)为原料制取Co3O4的工艺流程如图:
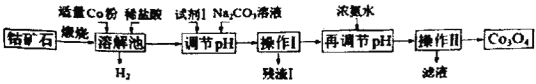
己知:Co与Fe为活泼金属,氧化性由强到弱的顺序为:Co3+>Fe3+>Co2+。
几种氢氧化物的溶度积如下表:
氢氧化物 | Co(OH)2 | Fe(OH)2 | Co(OH)3 | Al(OH)3 | Fe(OH)3 |
溶度积(Ksp) | 2.0×10-15 | 8.0×10-16 | 2.0×10-44 | 1.3×10-33 | 4.0×10-39 |
下列有关说法错误的是
A.溶解池中生成H2的离子反应方程式为:Co+2H+=Co2++H2↑
B.加入试剂1的目的是将Fe2+氧化为Fe3+,试剂1可选用双氧水或碘水
C.残渣1的主要成分为Fe(OH)3
D.操作Ⅱ包括过滤、洗涤、干燥和灼烧四个步骤
【题目】1L恒容密闭容器中充入2molNO和1molCl2反应:2NO(g)+Cl2(g)![]() 2NOCl(g),在温度分别为T1、T2时测得NO的物质的量与时间的关系如表所示,正确的是
2NOCl(g),在温度分别为T1、T2时测得NO的物质的量与时间的关系如表所示,正确的是
t/min 温度/℃ | 0 | 5 | 8 | 13 |
T1 | 2 | 1.5 | 1.3 | 1.0 |
T2 | 2 | 1.15 | 1.0 | 1.0 |
A.T1>T2
B.T1时,反应前5min的平均速率为v(Cl2)=0.5mol·L-1·min-1
C.反应达平衡时,升高温度促进反应向正反应方向进行
D.T2时,向反应后的容器中充入2molNOCl(g),再次平衡时,c(NOCl)>2mol·L-1

