题目内容
化学反应原理在科研和生产中有广泛应用。
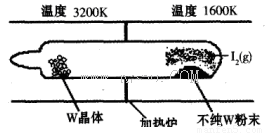
(1)利用“化学蒸气转移法”提纯金属钨的反应原理为W(s)+I2(g) WI2(g) (I)。该反应在石英真空管中进行,如下图所示:
WI2(g) (I)。该反应在石英真空管中进行,如下图所示:
①反应(I)的平衡常数表达式K=_______,若K= ,向某恒容密闭容器中加入1mol I2(g)和足量W(s),反应达到平衡时I2(g)的转化率为__________。
,向某恒容密闭容器中加入1mol I2(g)和足量W(s),反应达到平衡时I2(g)的转化率为__________。
②反应(I)的△H____0(填“>”或“<”),上述反应体系中可循环使用的物质是_________。
③能够说明上述反应已经达到平衡状态的有_________(填序号)。
a.I2与WI2的浓度相等
b.W的质量不再变化
c.容器内混合气体的密度保持不变
d.单位时间内,金属钨消耗的物质的量与碘化钨生成的物质的量相等
(2)25℃时,NaHSO3的水解平衡常数=1.0×10-12mol/L,则该温度下H2SO3 HSO3-+H+的电离常数Ka=____mol/L,若向H2SO3溶液中加入少量的I2,则溶液中
HSO3-+H+的电离常数Ka=____mol/L,若向H2SO3溶液中加入少量的I2,则溶液中 将________(填“增大”、“减小”或“不变”)。
将________(填“增大”、“减小”或“不变”)。
(3)直接排放含SO2的烟气会形成酸雨,危害环境。用Na2SO3溶液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
n(SO32-): n ( HSO3-) | 91:9 | 1:1 | 1:91 |
pH(25℃) | 8.2 | 7.2 | 6.2 |
当吸收液呈中性时,溶液中离子浓度由大到小的顺序为_________________________。
(1)① (2分,化学式写错不得分,漏写“c( )”其他正确只得1分)? 33.3%? 或33%(2分,合理答案即可)② <(2分,写“小于”不得分)?? I2(或碘)(2分,写“化学式”或“名称”均得分)③bc (b 1分,c 1分,b、c 2分,其他情况不得分,大写字母不得分)
(2分,化学式写错不得分,漏写“c( )”其他正确只得1分)? 33.3%? 或33%(2分,合理答案即可)② <(2分,写“小于”不得分)?? I2(或碘)(2分,写“化学式”或“名称”均得分)③bc (b 1分,c 1分,b、c 2分,其他情况不得分,大写字母不得分)
(2)1.0×10-2 (2分,或10-2或0.01)? 减小 (2分)
(3)c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)(2分,顺序错误不得分,离子符号写错不得分,漏写“c( )”其他正确只得1分)
【解析】
试题分析:(1)①化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,因此根据反应的方程式W(s)+I2(g) WI2(g)可知,该反应的平衡常数表达式K=
WI2(g)可知,该反应的平衡常数表达式K=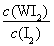 ,根据方程式可知
,根据方程式可知
W(s)+I2(g) WI2(g)
WI2(g)
起始量(mol)??????? 1??????? 0
转化量(mol)???? ?? x??????? x
平衡量(mol)????? 1-x?????? x
由于反应前后体积不变,则可以用物质的量代替浓度表示平衡常数
所以K=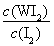 =
=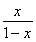 =
=
解得x=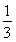
所以反应达到平衡时I2(g)的转化率为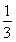 ×100%=33.3%。
×100%=33.3%。
②根据装置图可知,单质W在温度较高的情况下有利于生成,这说明升高温度平衡向逆反应方向移动,所以正方应是放热反应,即△H<0。
③在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,据此判断。a.平衡时浓度不变,但物质的浓度之间不一定相等或满足某种关系,所以I2与WI2的浓度相等不能说明反应达到平衡状态,a不正确;b.W的质量不再变化,说明正逆反应速率相等,达到平衡状态,b正确;c.密度是混合气的质量和容器容积的比值,在反应过程中容积始终是不变的,但气体的质量是变化的,因此密度是变化的,所以当容器内混合气体的密度保持不变时可以说明反应达到平衡状态,c正确;d.单位时间内,金属钨消耗的物质的量与碘化钨生成的物质的量相等,但二者的反应速率方向是一致的,因此不能说明反应达到平衡状态,d不正确,答案选bc。
(2)NaHSO3的水解方程式为HSO3-+H2O H2SO3+OH-,则水解平衡常数表达式=
H2SO3+OH-,则水解平衡常数表达式= ,则
,则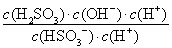 =
=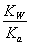 =1.0×10
=1.0×10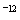 mol/L,所以该温度下H2SO3
mol/L,所以该温度下H2SO3 HSO3-+H+的电离常数Ka=
HSO3-+H+的电离常数Ka=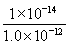 =1.0×10-2mol/L;若向H2SO3溶液中加入少量的I2,由于单质碘能把亚硫酸氧化生成硫酸,所以使亚硫酸的电离平衡向逆反应方向移动,因此溶液中
=1.0×10-2mol/L;若向H2SO3溶液中加入少量的I2,由于单质碘能把亚硫酸氧化生成硫酸,所以使亚硫酸的电离平衡向逆反应方向移动,因此溶液中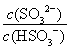 将减小。
将减小。
(3)根据表中数据可知,当n(SO32-): n ( HSO3-)=1:1时溶液显碱性,因此当溶液显中性时n(SO32-): n ( HSO3-)<1:1,所以溶液中离子浓度大小关系是c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)。
考点:考查平衡常数的判断、计算与应用;外界条件对平衡状态、水解平衡的影响;以及溶液中离子浓度大小比较

 阅读快车系列答案
阅读快车系列答案化学反应原理在科研和生产中有广泛应用。
Ⅰ、如图装置所示,A、B中的电极为多孔的惰性电极;C、D为夹在浸有Na2SO4溶液的滤纸条上的铂夹;电源有a、b两极。若A、B中充满KOH溶液后倒立于KOH溶液的水槽中。切断K1,闭合K2、K3通直流电。

回答下列问题:
(1) a是电源的 极,写出A中的电极反应式为_____。
(2)湿的Na2SO4滤纸条上能观察到的现象有____________。
(3)电解一段时间后,A、B中均有气体包围电极,若此时切断K2、K3,闭合K1,发现电流表的指针移动,写出此时B中的电极反应式为 。
Ⅱ、甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上一般采用下列反应合成甲醇:CO(g)+2H2(g)
 CH3OH(g)
ΔH,下表所列数据是该反应在不同温度下的化学平衡常数(K)。请回答下列问题:
CH3OH(g)
ΔH,下表所列数据是该反应在不同温度下的化学平衡常数(K)。请回答下列问题:
|
温度 |
250℃ |
300℃ |
350℃ |
|
K |
2.041 |
0.270 |
0.012 |
(4)由表中数据判断ΔH 0(填“>”、“<”或“=”)。
(5)其他条件不变,只改变其中一个条件,下列措施可提高甲醇产率的是 。
A.升高温度;B.使用合适的催化剂;C.缩小容器的容积;D.充入过量的H2;E.恒压时,充入He;F.从体系中分离出CH3OH
(6)某温度下,将2mol CO和6 mol H2充入2L密闭容器中,反应进行到4min末达到平衡,此时测得c(CO) =0.2 mol/L ,则0~4min内H2的反应速率为 ;若保持温度容积不变再向其中充入一定量的CH3OH,重新达到化学平衡状态,与原平衡状态相比,此时平衡混合气体中CH3OH的体积分数 (填“变大”、“变小”、或“不变”)。
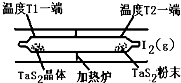
 (2)如图所示,反应(I)在石英真空管中进行,先在温度为T2的一端放入未提纯的TaS2粉末和少量I2(g),一段时间后,在温度为T1的一端得到了纯净的TaS2晶体,则温度T1 T2(填“﹥”“﹤”或“=”)。上述反应体系中循环使用的物质是 。
(2)如图所示,反应(I)在石英真空管中进行,先在温度为T2的一端放入未提纯的TaS2粉末和少量I2(g),一段时间后,在温度为T1的一端得到了纯净的TaS2晶体,则温度T1 T2(填“﹥”“﹤”或“=”)。上述反应体系中循环使用的物质是 。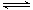 TaI4(g)+S2(g) (Ⅰ)
TaI4(g)+S2(g) (Ⅰ)
 TaI4(g)+S2(g) △H﹥0 (Ⅰ)反应(Ⅰ)的平衡常数表达式K= ,若K=1,向某恒容密闭容器中加入1mol I2(g)和足量TaS2(s),I2(g)的平衡转化率为 ,
TaI4(g)+S2(g) △H﹥0 (Ⅰ)反应(Ⅰ)的平衡常数表达式K= ,若K=1,向某恒容密闭容器中加入1mol I2(g)和足量TaS2(s),I2(g)的平衡转化率为 ,
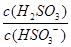 将 (填“增大”“减小”或“不变”)。
将 (填“增大”“减小”或“不变”)。