题目内容
化学反应原理在科研和生产中有广泛应用
(1)利用“化学蒸气转移法”制备TaS2晶体,发生如下反应TaS2(s)+2I2(g) TaI4(g)+S2(g) △H﹥0 (Ⅰ)反应(Ⅰ)的平衡常数表达式K= ,若K=1,向某恒容密闭容器中加入1mol I2(g)和足量TaS2(s),I2(g)的平衡转化率为 ,
TaI4(g)+S2(g) △H﹥0 (Ⅰ)反应(Ⅰ)的平衡常数表达式K= ,若K=1,向某恒容密闭容器中加入1mol I2(g)和足量TaS2(s),I2(g)的平衡转化率为 ,
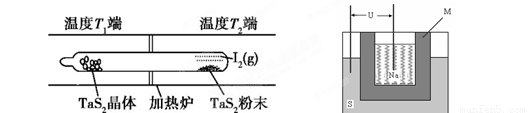
(2)如图所示,反应(Ⅰ)在石英真空管中进行,先在温度为T2的一端放入未提纯的TaS2粉末和少量I2(g),一段时间后,在温度为T1的一端得到了纯净的TaS2晶体,则温度T1 T2(填“﹥”“﹤”或“=”)。上述反应体系中循环使用的物质是 。

(3)利用I2的氧化性可测定钢铁中硫的含量。做法是将钢样中的硫转化为 H2SO3,然后用一定浓度的I2溶液进行滴定,所用指示剂为 ,滴定反应的离子方程式为 ,
(4)25℃时,H2SO3 HSO3-+H+的电离常数Ka=1×10-2mol/L,则该温度下NaHSO3的水解平衡常数Kh= mol/L,若向NaHSO3溶液中加入少量的I2,则溶液中
HSO3-+H+的电离常数Ka=1×10-2mol/L,则该温度下NaHSO3的水解平衡常数Kh= mol/L,若向NaHSO3溶液中加入少量的I2,则溶液中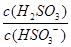 将 (填“增大”“减小”或“不变”)。
将 (填“增大”“减小”或“不变”)。
(1)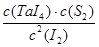 ;66.7%;
;66.7%;
(2)<; I2;
(3)淀粉; H2SO3+I2+H2O=2I-+SO42-+4H+;
(4)1.0×10-12;增大。
【解析】
(1)根据题给的化学方程式:TaS2(s)+2I2(g) TaI4(g)+S2(g),可知K=
TaI4(g)+S2(g),可知K=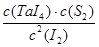 ;由于K=1,设平衡时TaI4和S2的物质的量为x,则根据平衡常数可列式:(x/V)2=【(1-2x)/V】2,即:x2=(1-2x)2,解得x=1/3,故I2(g)的平衡转化率为:(2/3)×100%=66.7%;
;由于K=1,设平衡时TaI4和S2的物质的量为x,则根据平衡常数可列式:(x/V)2=【(1-2x)/V】2,即:x2=(1-2x)2,解得x=1/3,故I2(g)的平衡转化率为:(2/3)×100%=66.7%;
(2)分析题给的化学方程式:TaS2(s)+2I2(g) TaI4(g)+S2(g) △H﹥0,该反应正向吸热;由于反应先在T2端开始,一段时间后在T1端得到晶体,说明反应生成的气体在T1端温度降低平衡左移,故温度T1<T2;在上述变化过程中I2可以循环使用;
TaI4(g)+S2(g) △H﹥0,该反应正向吸热;由于反应先在T2端开始,一段时间后在T1端得到晶体,说明反应生成的气体在T1端温度降低平衡左移,故温度T1<T2;在上述变化过程中I2可以循环使用;
(3)利用I2的氧化性可测定钢铁中硫的含量时的指示剂是淀粉,反应的离子方程式为:H2SO3+I2+H2O= 2I-+SO42-+4H+;
(4)根据NaHSO3的水解方程式:HSO3-+H2O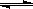 H2SO3+OH-,其水解平衡常数的表达式为:Kh=c(H2SO3)×c(OH-)/c(HSO3-),故Ka×Kh= c(H+)×c(OH-)=Kw,可求出Kh
=1.0×10-12;若向NaHSO3溶液中加入少量的I2,溶液中发生反应:HSO32-+I2+H2O=SO42-+2I-+3H+,氢离子结合氢氧根离子,使平衡向右移动,造成溶液中
H2SO3+OH-,其水解平衡常数的表达式为:Kh=c(H2SO3)×c(OH-)/c(HSO3-),故Ka×Kh= c(H+)×c(OH-)=Kw,可求出Kh
=1.0×10-12;若向NaHSO3溶液中加入少量的I2,溶液中发生反应:HSO32-+I2+H2O=SO42-+2I-+3H+,氢离子结合氢氧根离子,使平衡向右移动,造成溶液中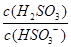 增大。
增大。
【考点定位】此题综合考查了化学平衡常数、电离平衡常数和水解平衡常数、平衡转化率、化学平衡的移动、滴定指示剂的选择等知识。

 阅读快车系列答案
阅读快车系列答案化学反应原理在科研和生产中有广泛应用。
Ⅰ、如图装置所示,A、B中的电极为多孔的惰性电极;C、D为夹在浸有Na2SO4溶液的滤纸条上的铂夹;电源有a、b两极。若A、B中充满KOH溶液后倒立于KOH溶液的水槽中。切断K1,闭合K2、K3通直流电。

回答下列问题:
(1) a是电源的 极,写出A中的电极反应式为_____。
(2)湿的Na2SO4滤纸条上能观察到的现象有____________。
(3)电解一段时间后,A、B中均有气体包围电极,若此时切断K2、K3,闭合K1,发现电流表的指针移动,写出此时B中的电极反应式为 。
Ⅱ、甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上一般采用下列反应合成甲醇:CO(g)+2H2(g)
 CH3OH(g)
ΔH,下表所列数据是该反应在不同温度下的化学平衡常数(K)。请回答下列问题:
CH3OH(g)
ΔH,下表所列数据是该反应在不同温度下的化学平衡常数(K)。请回答下列问题:
|
温度 |
250℃ |
300℃ |
350℃ |
|
K |
2.041 |
0.270 |
0.012 |
(4)由表中数据判断ΔH 0(填“>”、“<”或“=”)。
(5)其他条件不变,只改变其中一个条件,下列措施可提高甲醇产率的是 。
A.升高温度;B.使用合适的催化剂;C.缩小容器的容积;D.充入过量的H2;E.恒压时,充入He;F.从体系中分离出CH3OH
(6)某温度下,将2mol CO和6 mol H2充入2L密闭容器中,反应进行到4min末达到平衡,此时测得c(CO) =0.2 mol/L ,则0~4min内H2的反应速率为 ;若保持温度容积不变再向其中充入一定量的CH3OH,重新达到化学平衡状态,与原平衡状态相比,此时平衡混合气体中CH3OH的体积分数 (填“变大”、“变小”、或“不变”)。
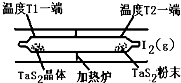
 (2)如图所示,反应(I)在石英真空管中进行,先在温度为T2的一端放入未提纯的TaS2粉末和少量I2(g),一段时间后,在温度为T1的一端得到了纯净的TaS2晶体,则温度T1 T2(填“﹥”“﹤”或“=”)。上述反应体系中循环使用的物质是 。
(2)如图所示,反应(I)在石英真空管中进行,先在温度为T2的一端放入未提纯的TaS2粉末和少量I2(g),一段时间后,在温度为T1的一端得到了纯净的TaS2晶体,则温度T1 T2(填“﹥”“﹤”或“=”)。上述反应体系中循环使用的物质是 。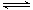 TaI4(g)+S2(g) (Ⅰ)
TaI4(g)+S2(g) (Ⅰ)