题目内容
【题目】大气中的部分碘源于O3对海水中I-的氧化。某科学小组进行O3与含I-溶液反应相关研究。
(1)O3将I-氧化生成I2的过程由3步反应组成:
①I-(aq)+O3(g)![]() IO-(aq)+O2(g) ΔH1
IO-(aq)+O2(g) ΔH1
②IO-(aq)+H+(aq)![]() HIO(aq) ΔH2
HIO(aq) ΔH2
③HIO(aq)+I-(aq)+H+(aq)![]() I2(aq)+H2O(l) ΔH3
I2(aq)+H2O(l) ΔH3
用热化学方程式表示O3氧化I-生成I2的反应___。
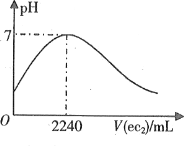
(2)O3在水中易分解,在一定条件下,O3的浓度减少一半时所需的时间(t)如下表所示。已知:O3的起始浓度为0.0216mol·L-1。
pH t/min T/℃ | 3.0 | 4.0 | 5.0 | 6.0 |
20 | 301 | 231 | 169 | 58 |
30 | 158 | 108 | 48 | 15 |
50 | 31 | 35 | 15 | 7 |
①在30℃、pH=4.0条件下,O3的分解速率为___mol·L-1·min-1。
②pH增大能加速O3分解,表明对O3分解起催化作用的是____。
③根据表中数据,推测O3在下列条件下分解速率依次增大的顺序为___(填字母)。
a.40℃、pH=3.0 b.10℃、pH=4.0 c.30℃、pH=7.0
【答案】O3(g)+2I-(aq)+2H+(aq)=I2(aq)+H2O(l)+O2(g) △H=△H1+△H2+△H3 1.00×10-4 OH- bac
【解析】
(1)反应为O3氧化I-生成I2,根据盖斯定律①+②+③可得总反应以及△H;
(2)①根据υ=△c÷△t计算;
②pH增大,则OH-浓度增大;
③根据表中数据判断pH和温度对分解速率的影响;
(1)将所给的三个反应:①+②+③可得总反应:2I-(aq)+O3(g)+2H+(aq)=I2(aq)+O2(g)+H2O(l),△H=△H1+△H2+△H3 ;
(2)①υ=△c÷△t=0.0108mol·L-1÷108min=1.00×10-4mol/(L·min);
②pH增大,则OH-浓度增大,pH增大能加速O3分解,表明对O3分解起催化作用的是OH-;
③由表中数据可知,40°C、pH=3.0时,所需时间在31min~158min之间;
10°C、pH=4.0时,所需时间>231min;
30°C、pH=7.0时,所需时间<15min,则分解速率依次增大的顺序为b、a、c。

 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案【题目】硼酸(H3BO3)溶液中存在:H3BO3(aq)+H2O(l)![]() [B(OH)4]-(aq)+H+(aq)。下列说法正确的是
[B(OH)4]-(aq)+H+(aq)。下列说法正确的是
化学式 | 电离常数(298K) |
硼酸 | K=5.7×10-10 |
碳酸 | K1=4.4×10-7 K2=4.7×10-11 |
醋酸 | K=1.75×10-5 |
A.等物质的量浓度的碳酸钠溶液和醋酸钠溶液比较,pH:前者>后者
B.等物质的量浓度的碳酸溶液和硼酸溶液比较,pH:前者>后者
C.将一滴碳酸钠溶液滴入硼酸溶液中一定能观察到有气泡产生
D.将一滴醋酸溶液滴入碳酸钠溶液中一定能观察到有气泡产生