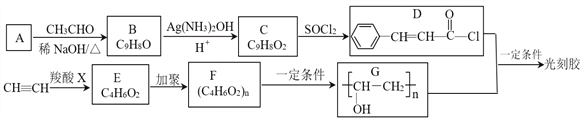
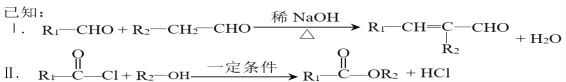
题目内容
【题目】利用反应NO2(g)+SO2(g)![]() SO3(g)+NO(g)+Q(Q>0)可处理NO2、SO2等大气污染物,具有十分重要的意义。
SO3(g)+NO(g)+Q(Q>0)可处理NO2、SO2等大气污染物,具有十分重要的意义。
完成下列填空:
(1)该反应中被氧化的元素是__________;写出该反应的平衡常数表达式:K =_____________。
(2)若上述反应在一密闭容器中进行。下列能表明反应达到平衡状态的是_______(选填编号)。
a.混合气体颜色保持不变
b.NO2和NO的体积比保持不变
c.每消耗1mol SO2的同时生成1mol SO3
d.体系中气体密度保持不变
(3)一定温度下,在容积为V L的容器中发生上述反应,t min内,SO2的物质的量下降了a mol,则这段时间内v(NO) =__________(用相关字母表示并注明单位)。
(4)请写出两种能提高SO2转化率的措施:_____________、_____________。
(5)亚硫酸溶液久置,pH会变小,请用方程式表示其原因_______________
(6)将SO2持续通入NaOH溶液中,溶液中SO32—的浓度变化如图所示,请解释原因。
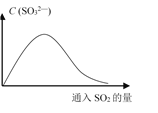
__________________
【答案】 SO2中+4价的S [SO3][NO]/[NO2][SO2] ab a/Vt mol/(L·min) 通入NO2 移走NO或SO3、降低温度、通入O2等(任写两种) 2H2SO3 + O2 → 2H2SO4 SO2与OH—反应生成SO32—,因此SO32—浓度增大;继续通入SO2时,SO2与SO32—反应生成HSO3—,导致SO32—浓度减小
【解析】(1)该反应中S元素化合价从+4价升高到+6价,被氧化的元素是S;根据方程式可知该反应的平衡常数表达式:K=[SO3][NO]/[NO2][SO2]。(2)a.混合气体颜色保持不变说明NO2浓度不再发生变化,说明反应达到平衡状态,a正确;b.NO2和NO的体积比保持不变说明正逆反应速率相等,达到平衡状态,b正确;c.每消耗1mol SO2的同时生成1mol SO3均表示正反应速率,不能说明反应达到平衡状态,c错误;d.密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,因此体系中气体密度保持不变不能说明,d错误,答案选ab;(3)一定温度下,在容积为V L的容器中发生上述反应,t min内,SO2的物质的量下降了a mol,则这段时间内生成NO是amol,所以v(NO) = a/Vt mol/(L·min)。(4)正反应是放热反应,所以能提高SO2转化率的措施有通入NO2、移走NO或SO3、降低温度、通入O2等。(5)亚硫酸易被氧化为强酸硫酸,因此溶液久置,pH会变小,方程式为2H2SO3+O2→2H2SO4。(6)SO2是酸性氧化物,通入氢氧化钠溶液中,SO2与OH—反应生成SO32—,因此SO32—浓度增大;继续通入SO2时,SO2与SO32—反应生成HSO3—,导致SO32—浓度减小。

 名校课堂系列答案
名校课堂系列答案