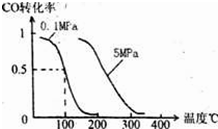
题目内容
降低大气中CO2的含量及有效地开发利用CO2,目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,先进行如下实验,在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示.
①从反应开始到平衡,氢气的平均反应速率v(H2)=______mol/(L?min);
②氢气的转化率=______;
③该反应的平衡常数为______(保留小数点后2位);
④下列措施中能使平衡体系中n(CH3OH)/n(CO2)增大的是______.
A.升高温度
B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离出去
D.再充入1molCO2和3molH2.
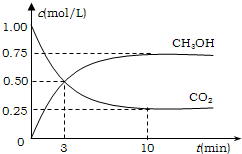
①从反应开始到平衡,氢气的平均反应速率v(H2)=______mol/(L?min);
②氢气的转化率=______;
③该反应的平衡常数为______(保留小数点后2位);
④下列措施中能使平衡体系中n(CH3OH)/n(CO2)增大的是______.
A.升高温度
B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离出去
D.再充入1molCO2和3molH2.

(1)①利用三段式解题法计算
CO2(g)+3H2(g) CH3OH(g)+H2O(g),
CH3OH(g)+H2O(g),
开始(mol/L):1 30 0
变化(mol/L):0.75 2.250.75 0.75
平衡(mol/L):0.25 0.75 0.750.75
从反应开始到平衡,氢气的平均反应速率v(H2)=
=0.225mol?L-1?min-1,
故答案为:0.225;
②氢气的转化率=
×100%=75%,
故答案为:75%;
②平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,则k=
=
=5.33,
故答案为:5.33;
③要使n(CH3OH)/n(CO2)增大,应使平衡向正反应方向移动,
A.因正反应放热,升高温度平衡向逆反应方向移动,则n(CH3OH)/n(CO2)减小,故A错误;
B.充入He(g),使体系压强增大,但对反应物质来说,浓度没有变化,平衡不移动,n(CH3OH)/n(CO2)不变,故D错误.故B错误;
C.将H2O(g)从体系中分离,平衡向正反应方法移动,n(CH3OH)/n(CO2)增大,故C正确;
D.再充入1molCO2和3molH2,等效于在原来基础上缩小体积一半,压强增大,平衡向正反应方向移动,则n(CH3OH)/n(CO2)增大,故D正确.
故答案为:CD.
CO2(g)+3H2(g)
 CH3OH(g)+H2O(g),
CH3OH(g)+H2O(g),开始(mol/L):1 30 0
变化(mol/L):0.75 2.250.75 0.75
平衡(mol/L):0.25 0.75 0.750.75
从反应开始到平衡,氢气的平均反应速率v(H2)=
| 2.25mol/L |
| 10min |
故答案为:0.225;
②氢气的转化率=
| 2.25 |
| 3 |
故答案为:75%;
②平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,则k=
| c(CH3OH)c(H2O) |
| c(CO2)c3(H2) |
| 0.75×0.75 |
| 0.25×0.753 |
故答案为:5.33;
③要使n(CH3OH)/n(CO2)增大,应使平衡向正反应方向移动,
A.因正反应放热,升高温度平衡向逆反应方向移动,则n(CH3OH)/n(CO2)减小,故A错误;
B.充入He(g),使体系压强增大,但对反应物质来说,浓度没有变化,平衡不移动,n(CH3OH)/n(CO2)不变,故D错误.故B错误;
C.将H2O(g)从体系中分离,平衡向正反应方法移动,n(CH3OH)/n(CO2)增大,故C正确;
D.再充入1molCO2和3molH2,等效于在原来基础上缩小体积一半,压强增大,平衡向正反应方向移动,则n(CH3OH)/n(CO2)增大,故D正确.
故答案为:CD.

练习册系列答案
相关题目
 2NH3(g)△H =-92.2kJ/mol。在该条件下向一绝热的密闭的容器中加入1mol N2和3mol H2,使之充分反应,测得放出的热量总是小于92.2kJ,其主要原因是 。
2NH3(g)△H =-92.2kJ/mol。在该条件下向一绝热的密闭的容器中加入1mol N2和3mol H2,使之充分反应,测得放出的热量总是小于92.2kJ,其主要原因是 。 2NH3,用υ(H2)和υ(N2)分别表示其中的化合反应的速率,用υ(NH3)表示其中分解反应的速率。下列能说明反应已达到平衡状态的是( )
2NH3,用υ(H2)和υ(N2)分别表示其中的化合反应的速率,用υ(NH3)表示其中分解反应的速率。下列能说明反应已达到平衡状态的是( )