题目内容
无水MgBr2可用作催化剂。实验室采用镁屑与液溴为原料制备无水MgBr2,装置如下图所示(夹持仪器略去)。主要步骤如下:

步骤l:三颈瓶中装入10g镁屑和150mL无水乙醚,装置B中加入适量的液溴。
步骤2:缓慢通入干燥的氮气,直至溴完全导入三颈瓶中。
步骤3:反应完毕后恢复至室温,过滤,将滤液转移至另一干燥的烧瓶中,冷却至0℃,析出晶体,再过滤得三乙醚合溴化镁粗品。
步骤4:常温下用苯溶解粗品,冷却至0℃,析出晶体,过滤,洗涤得三乙醚合溴化镁,加热至160℃分解得无水MgBr2产品。
已知:①Mg和Br2反应剧烈放热;MgBr2具有强吸水性。
②MgBr2+3C2H5OC2H5= MgBr2·3C2H5OC2H5
请回答:
(1)仪器A的名称是___________,它在实验中的作用是____________。
(2)步骡2中,可以将B装置中的溴完全导入三颈瓶中的原因是_______;该实验如果将所用液溴一次性全部加入三颈瓶中,其后果是_____________。
(3)步骡3中,第一次过滤得到的固体物质是______;根据步骤3、4,请总结出三乙醚合溴化镁所具有的物理性质:_________。
(4)请根据Mg的性质设计实验证明O2的氧化性比N2的强:________。
(5)将步骤得到的产品在干燥器中冷却到室温后,称量,其质量为61.4g。则该实验制取MgBr2的产率是_____________。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案氯化亚铜(CuCl)广泛用于化工、印染、有机合成等行业。CuCl难溶于醇和水,可溶于氯离子浓度较大的体系,在潮湿空气中易水解氧化。以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产氯化亚铜的工艺过程如下图所示。

回答下列问题:
(1)CuCl中Cu元素在周期表中的位置为___________。
(2)步骤①中N元素被还原为最低价,则Cu溶解的离子方程式为________。溶解温度应控制在60~70℃,原因是______________。
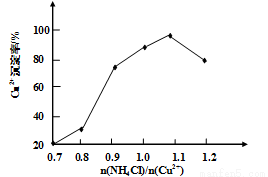
(3)写出步骤③中主要反应的离子方程式________。(NH4)2SO3要适当过量,目的有:保证Cu2+的还原速率,__________。已知NH4Cl、Cu2+的物质的量之比 与Cu2+沉淀率的关系如图所示,当氯化铵用量增加到一定浓度后氯化亚铜的沉淀率减少,原因是________。
与Cu2+沉淀率的关系如图所示,当氯化铵用量增加到一定浓度后氯化亚铜的沉淀率减少,原因是________。
(4)步骤⑥加入乙醇洗涤的目的是__________。
(5)氯化亚铜的定量分析:
①称取样品0.250g和10mL过量的FeCl3溶液于250mL锥形瓶中,充分溶解;
②用0.100mol·L-1硫酸铈[Ce(SO4)2]标准溶液测定。已知:CuCl+FeCl3=CuCl2+FeCl2、Fe2++Ce4+=Fe3++Ce3+。
三次平衡实验结果如下表(平衡实验结果相差不能超过1%):
平衡实验次数 | 1 | 2 | 3 |
0.250g样品消耗硫酸铈标准溶液的体积(mL) | 24.35 | 24.05 | 23.95 |
则样品中CuCl的纯度为_______(结果保留3位有效数字)。
下列有关实验操作、现象、解释或结论都正确的是
选项 | 实验操作 | 现象 | 解释或结论 |
A | 充分吸收了Na2SiO3饱和溶液的小木条,沥干后放在酒精灯外焰加热 | 小木条不燃烧 | Na2SiO3可作防火剂 |
B | 将H2再充满Cl2的集气瓶中燃烧 | 集气瓶口上方有白烟生成 | H2、Cl2化合生成HCl |
C | 将SO2通入酸性高锰酸钾溶液中 | 溶液褪色 | SO2具有漂白性 |
D | 出去表面氧化膜的铝箔,在酒精灯上充分加热 | 铝不能滴落下来 | 铝熔点高,没能熔化 |
A. A B. B C. C D. D
在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
时间(s) C(mol/L) | 0 | 20 | 40 | 60 | 80 | 100 |
C(N2O4) | 0. 20 | a | 0.10 | c | d | e |
C(NO2) | 0.00 | 0.12 | b | 0.22 | 0.22 | 0.22 |
反应进行至100s后将反应混合物的温度降低,发现气体的颜色变浅。
(1)该反应的化学方程式为__________________________,表中b_________c(填“<”、“=”、“>”)。
(2)20s时,N2O4的的浓度为__________________mol·L-1,0~20s内N2O4的平均反应速率为________________;
(3)该反应的平衡常数表达式K=___________________
在80℃时该反应的平衡常数K值为:______________(保留到小数点后2位)。
(4)在其他条件相同时,该反应的K值越大,表明建立平衡时____________。
A.N2O4的转化率越高 B.NO2的产量越大
C.N2O4与NO2的浓度之比越大 D.正反应进行的程度越大



 B. 葡萄糖的结构简式:C6H12O6
B. 葡萄糖的结构简式:C6H12O6 D. 硫酸的电离方程式:H2SO4═H22++SO42﹣
D. 硫酸的电离方程式:H2SO4═H22++SO42﹣