题目内容
取5.64gCu(NO3)2无水晶体,强热使其分解,得到NO2、O2和2.32固体氧化物。将气体用水充分吸收后,还有气体剩余,同时得到100mL溶液。请通过计算确定:(写出计算过程)
(1)所得溶液的物质的量浓度;
(2)残留固体的成分和质量分别是多少克?
(1)所得溶液的物质的量浓度;
(2)残留固体的成分和质量分别是多少克?
(1)0.6mol/L
(2)Cu2O为0.72g(2分),CuO为1.60g
(2)Cu2O为0.72g(2分),CuO为1.60g
假设固体氧化物全部为CuO,则:2Cu(NO3)2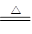 2CuO+4NO2↑+O2↑
2CuO+4NO2↑+O2↑
另外气体被水吸收的方程式为:4NO2+O2+2H2O=4HNO3
可看出,气体将被水全部吸收,且5.64gCu(NO3)2无水晶体(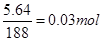 )生成的CuO为0.03×80=2.4g,故固体氧化物中除CuO外,还有Cu2O:4CuO
)生成的CuO为0.03×80=2.4g,故固体氧化物中除CuO外,还有Cu2O:4CuO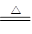 2Cu2O+O2↑
2Cu2O+O2↑
(1)从以上分析可看出,剩余气体为氧气,故N元素全部转化为硝酸,所得溶液的浓度为 0.6mol/L
0.6mol/L
(2)设固体氧化物中CuO、Cu2O的物质的量分别为x、y
则80x+144y=2.32
再由铜的守恒可知:x+2y=0.03
得:x=0.02mol y=0.005mol
故CuO、Cu2O的质量分别为1.60g、0.72g
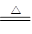 2CuO+4NO2↑+O2↑
2CuO+4NO2↑+O2↑另外气体被水吸收的方程式为:4NO2+O2+2H2O=4HNO3
可看出,气体将被水全部吸收,且5.64gCu(NO3)2无水晶体(
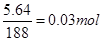 )生成的CuO为0.03×80=2.4g,故固体氧化物中除CuO外,还有Cu2O:4CuO
)生成的CuO为0.03×80=2.4g,故固体氧化物中除CuO外,还有Cu2O:4CuO 2Cu2O+O2↑
2Cu2O+O2↑(1)从以上分析可看出,剩余气体为氧气,故N元素全部转化为硝酸,所得溶液的浓度为
 0.6mol/L
0.6mol/L(2)设固体氧化物中CuO、Cu2O的物质的量分别为x、y
则80x+144y=2.32
再由铜的守恒可知:x+2y=0.03
得:x=0.02mol y=0.005mol
故CuO、Cu2O的质量分别为1.60g、0.72g

练习册系列答案
相关题目
 丙+丁
丙+丁
 ,此反应的化学方程式是 。
,此反应的化学方程式是 。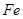 加到一定量丙
加到一定量丙
 ,发生反应的化学方程式是
,发生反应的化学方程式是  ;
; 一种物质的方法和现象是 。
一种物质的方法和现象是 。