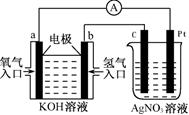
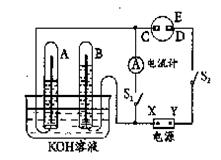
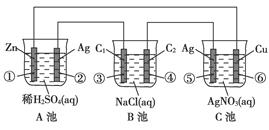
题目内容
某同学按右图所示的装置进行试验。A、B 为两种常见金属,它们的硫酸盐可溶于水。当 K 闭合时,在交换膜处 SO42一从右向左移动。下列分析错误的是
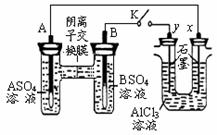
A.金属活动性A强于B
B.B电极反应B-2e-=B2+
C.x电极上有H2产生,发生还原反应
D.反应初期x电极周围出现白色沉淀,继续实验沉淀将溶解

A.金属活动性A强于B
B.B电极反应B-2e-=B2+
C.x电极上有H2产生,发生还原反应
D.反应初期x电极周围出现白色沉淀,继续实验沉淀将溶解
B
试题分析:交换膜处 SO42一从右向左移动,说明A电极是负极,B电极是正极,即A的金属性强于B的金属性,选项A正确;正极得到电子,发生还原反应,选项B不正确;x电极和电源的负极相连,作阴极溶液中的氢离子放电生成氢气,C正确;y电极是阳极,溶液中的氯离子放电生成氯气。由于氢离子发生破坏水的电离平衡,溶液显碱性,因此有氢氧化铝白色沉淀产生。由于氢氧化铝是两性氢氧化物,所以随着溶液碱性的增强,氢氧化铝又溶解,D正确,答案选B。
点评:在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应,据此可以进行有关的判断和计算。而在判断电解产物时,首先判断阳极电极材料。如果是活性电极,则电极本身失去电子。如果是惰性电极,则溶液中的阴离子失去电子。而阴极是溶液中的阳离子得到电子,所以需要熟练记住常见离子的放电顺序。

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目