题目内容
(11分)铁及铁的化合物应用广泛,如FeCl3可用做催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式是______________________。
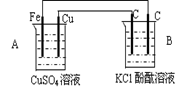
(2)若将?1?中的反应设计成原电池,请画出原电池的装置图__________________(标出正、负极材料及电解质溶液),并写出电极反应式。
正极反应________________,负极反应__________________。
(3)某科研人员发现劣质不锈钢在某些盐溶液中腐蚀现象明显。请从提供的药品:Cl2 浓H2SO4 NaOH溶液 CuO Cu中选择两种?水可任选?,设计最佳实验,验证劣质不锈钢易被腐蚀。
有关反应的化学方程式①_____________________________
②_____________________________。
劣质不锈钢腐蚀的实验现象_____________________________。
(4)Li—SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4—SOCl2。电池的总反应可表示为:4Li+2SOCl2=== 4LiCl+S+SO2。该电池正极发生的电极反应为____________________________。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式是______________________。
(2)若将?1?中的反应设计成原电池,请画出原电池的装置图__________________(标出正、负极材料及电解质溶液),并写出电极反应式。
正极反应________________,负极反应__________________。
(3)某科研人员发现劣质不锈钢在某些盐溶液中腐蚀现象明显。请从提供的药品:Cl2 浓H2SO4 NaOH溶液 CuO Cu中选择两种?水可任选?,设计最佳实验,验证劣质不锈钢易被腐蚀。
有关反应的化学方程式①_____________________________
②_____________________________。
劣质不锈钢腐蚀的实验现象_____________________________。
(4)Li—SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4—SOCl2。电池的总反应可表示为:4Li+2SOCl2=== 4LiCl+S+SO2。该电池正极发生的电极反应为____________________________。
(1)2Fe3++Cu===2Fe2++Cu2+
(2)装置图如下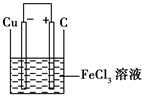
正极反应: 2Fe3++2e-===2Fe2+或Fe3++e-===2e2+
负极反应: Cu-2e-===Cu2+
(3)CuO+H2SO4===CuSO4+H2O CuSO4+Fe===FeSO4+Cu
不锈钢表面有红色物质生成,溶液颜色由蓝色变成浅绿色
(4)2SOCl2+4e-===4Cl-+S+SO2
(2)装置图如下

正极反应: 2Fe3++2e-===2Fe2+或Fe3++e-===2e2+
负极反应: Cu-2e-===Cu2+
(3)CuO+H2SO4===CuSO4+H2O CuSO4+Fe===FeSO4+Cu
不锈钢表面有红色物质生成,溶液颜色由蓝色变成浅绿色
(4)2SOCl2+4e-===4Cl-+S+SO2
试题分析:(1)Fe3+具有强氧化性,可以把一些金属单质如铁、铜等氧化成相应的离子,Fe3+腐蚀铜制电路板利用的就是这个原理,反应的离子方程式是:2Fe3+ + Cu====2Fe2+ + Cu2+。(2)在原电池中,负极失去电子,正极得到电子,由反应2Fe3++Cu=2Fe2++Cu2+可以判断出铜化合价升高,发生氧化反应,铜做负极,反应为:Cu-2e-===Cu2+。铁元素化合价降低,Fe3+ 发生还原反应,正极可以选用石墨棒,电解质溶液可以选用氯化铁溶液,反应为:Fe3++e-===2e2+。仿照教材上的铜锌原电池装置,可以画出原电池的装置图。(3)钢铁的腐蚀是单质铁变为阳离子,不锈钢在某些盐溶液中比在酸溶液中腐蚀明显,说明这些盐溶液中的金属阳离子的氧化性比H+的氧化性强,即这些金属在金属活动性顺序位于氢的后面。要设计实验验证劣质不锈钢易被腐蚀,需要有容易与铁反应的盐,根据提供的药品可知这种盐是硫酸铜,制取硫酸铜的最佳方案是用氧化铜与稀硫酸反应制取,这种方法比浓硫酸与铜反应节省硫酸,并且不产生污染环境的SO2。实验步骤是:1.用适量水将浓硫酸稀释制取稀硫酸,2.用氧化铜与稀硫酸反应制取硫酸铜,3.将不锈钢加入硫酸铜溶液中观察现象。(4)电池正极发生的是还原反应,根据电池总反应4Li+2SOCl2=== 4LiCl+S+SO2可知,SOCl2发生还原反应,得到S和SO2,反应方程式为:2SOCl2+4e-===4Cl-+S+SO2。
点评:实验设计与创新能力是高考的重点要求,因为它不仅可以锻炼学生的各种能力,而且还能够培养社会所需要的创新型人才,所以设计类题目是以后高考的重点,希望引起重视。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案
相关题目