题目内容
(16分)已知金属活动相差越大,形成原电池时越容易放电。请根据如图装置,回答下列问题:
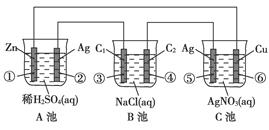
(1)各装置名称是:A池________,B池______,C池________。
(2)写出电极上发生的反应:①_____________,③___________,⑤_____________。
(3)当电路上有2 mol电子流过时,①极上质量变化______g,⑥极上质量变化______g。
(4)反应进行一段时间后,A、B、C三池中电解质溶液浓度不变的是________。

(1)各装置名称是:A池________,B池______,C池________。
(2)写出电极上发生的反应:①_____________,③___________,⑤_____________。
(3)当电路上有2 mol电子流过时,①极上质量变化______g,⑥极上质量变化______g。
(4)反应进行一段时间后,A、B、C三池中电解质溶液浓度不变的是________。
(1)原电池 电解池 电镀池 (2)Zn-2e-===Zn2+ 2Cl--2e-===Cl2↑ 2Ag-2e-===2Ag+ (3)65 216 (4)C池
由图中电极材料及电解质溶液可判断B池为电解池,A池、C池符合原电池条件,但由于Ag-Zn活动性差别比Ag-Cu活动性差别大,所以Ag-Zn原电池更容易放电,若A池、C池相连则C池为电解池,C池符合电镀条件,因此C池为电镀池。A池①极为原电池负极,电极反应Zn-2e-===Zn2+,B池③极为阳极,电极反应为2Cl--2e-===Cl2↑,C池⑤极发生:2Ag-2e-===2Ag+,由得失电子守恒可求出①、⑥电极上质量的变化;C池是电镀池,电镀过程中电解质溶液的浓度不变。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
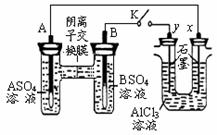
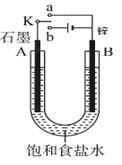
 VO2++V3++H20,下列说法正确的是( )
VO2++V3++H20,下列说法正确的是( )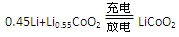 下列说法不正确的是
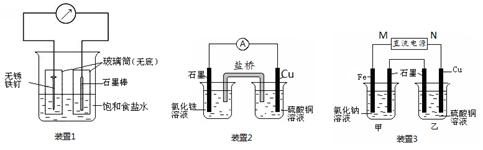
下列说法不正确的是 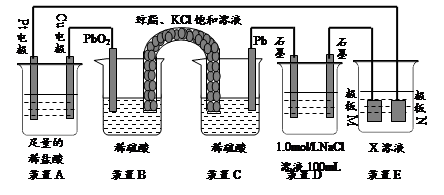
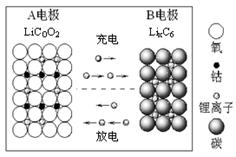
 Li1-xCoO2+LixC6
Li1-xCoO2+LixC6