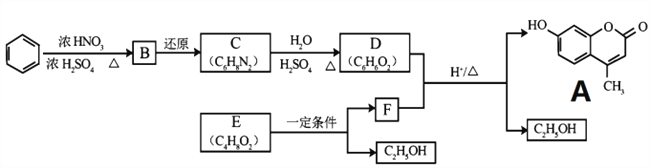
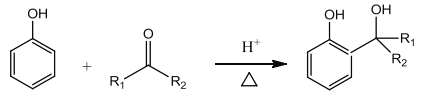
题目内容
【题目】下列说法正确的是( )
①检测乙醇中是否含有水可加入少量的无水硫酸铜,若变蓝则含水 ②除去乙醇中微量的水可加入金属钠,使其完全反应 ③获得无水乙醇的方法是直接加热蒸馏 ④乙酸与乙醇酯化反应时断裂碳氧键
A.①③B.②④C.①④D.③④
【答案】C
【解析】
①无水CuSO4遇水变蓝,用无水CuSO4可检验乙醇中是否有水存在,①正确;
②乙醇和水均与金属钠反应生成H2,所以不能用金属钠除去乙醇中微量的水,②错误;
③将含水的乙醇直接加热蒸馏,水也会挥发,所得乙醇不纯,通常先用生石灰吸水,然后再蒸馏,③错误;
④乙酸与乙醇发生酯化反应时,醇去氢原子,断裂氢氧键,酸去羟基,断裂碳氧键,④正确;
正确的有①④,答案选C。

 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案【题目】X、Y、Z、W 四种常见元素,其中 X、Y、Z 为短周期元素。有关信息如下:
原子或分子相关信息 | 单质及其化合物相关信息 | |
X | ZX4分子是由粗 Z 提纯 Z 的中间产物 | X 的最高价氧化物对应的水化物为无机酸中最强酸 |
Y | Y 原子的最外层电子数等于电子层数 | Y 的氧化物是典型的两性氧化物,可用于制造一种极有前途的高温材料 |
Z | Z 原子的最外层电子数是次外层电子数的 1/2 | Z 是无机非金属材料的主角,其单质是制取大规模集成电路的主要原料 |
W | W 原子的最外层电子数小于 4 | W 的常见化合价有+3、+2,WX3稀溶液呈黄色 |
(1) W 在周期表的位置为________________,W(OH)2在空气中不稳定,极易被氧化,由白色迅速变成灰绿色,最后变成红褐色,反应的化学方程式为_________________________。
(2)X 的最高价氧化物对应水化物的水溶液与 Y 的氧化物反应的离子方程式为_________________________。
(3) Z 的氧化物在通讯领域用来作__________________________________________,工业上制备 Z 的单质的化学反应方程式 为___________________________________________ 。锗与 Z 是同一主族元素,门捷列夫曾预言了这一元素的存在,它用 来制造半导体晶体管,最新研究表明:有机锗具有明显的抗肿瘤活性,锗不与 NaOH 溶液反应但在有H2O2存在时可与 NaOH 溶液反应生成锗酸盐,其方程式为_________________________。
(4)在50mL1mol·L-1的YX3溶液种逐滴加入0.5mol·L-1的NaOH溶液,得到1.56g沉淀,则加入NaOH溶液的体积可能___________种情况(填一或二)
【题目】用图所示装置检验乙烯时不需要除杂的是
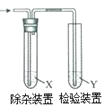
乙烯的制备 | 试剂X | 试剂Y | |
A | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 |
B | CH3CH2Br与NaOH乙醇溶液共热 | H2O | Br2的CCl4溶液 |
C | CH3CH2OH与浓H2SO4共热至170℃ | NaOH溶液 | KMnO4酸性溶液 |
D | CH3CH2OH与浓H2SO4共热至170℃ | NaOH溶液 | Br2的CCl4溶液 |