题目内容
7.设NA为阿伏加德罗常数的值,下列说法错误的是( )| A. | 32g O2所含的原子数目为NA | |
| B. | 0.5mol H2O含有的原子数目为1.5 NA | |
| C. | 1mol SO2含有的SO2分子数目为NA | |
| D. | 0.5NA个Cl2的物质的量是0.5 mol |
分析 A、氧气由氧原子构成;
B、水为三原子分子;
C、分子个数N=nNA;
D、物质的量n=$\frac{N}{{N}_{A}}$.
解答 解:A、氧气由氧原子构成,故32g氧气中含有的氧原子的物质的量n=$\frac{32g}{16g/mol}$=2mol,个数为2NA个,故A错误;
B、水为三原子分子,故0.5mol水中含1.5mol原子即1.5NA个,故B正确;
C、1mol二氧化硫中的分子个数N=nNA=1mol×NA/mol=NA,故C正确;
D、物质的量n=$\frac{N}{{N}_{A}}$=$\frac{0.5{N}_{A}}{{N}_{A}}$=0.5mol,故D正确.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
18.已知某铜、铁合金中铜和铁的物质的量之和为amol,其中Cu的物质的量分数为b,将其全部投入到50mL c mol•L-1的硝酸溶液中,加热使HNO3完全反应(假设NO是唯一的还原产物).则下列说法正确的是( )
| A. | 若金属全部溶解,则溶液中一定含有Fe3+ | |
| B. | 若金属有剩余,向溶液中再滴入硫酸后,金属不会发生溶解 | |
| C. | 当溶液中金属离子只含有Fe3+、Cu2+时,则c与a、b的关系为:c=80a$\frac{1-b}{3}$ | |
| D. | 若金属全部溶解,且产生336mL气体(标准状况),则c=0.3 |
2.同温同压下,密度相同的气体组是( )
| A. | CO、N2 | B. | NO、CH4 | C. | C2H4、NO | D. | SO2、Cl2 |
12.下列有关说法正确的是( )
| A. | 萃取操作可在普通漏斗中完成 | |
| B. | 浓烧碱液沾到皮肤上应立即用稀盐酸冲洗 | |
| C. | 用酒精灯加热试管内液体时一定要先给试管预热再集中加热液体部位 | |
| D. | 用托盘天平称出25.20g氯化钠 |
16.将4.6g钠和4.8g镁分别投入盛有等物质的量浓度、等体积的稀硫酸的两个烧杯中,反应后溶液质量分别为m g和n g,则不可能的关系为( )
| A. | m=n | B. | m>n | C. | m<n | D. | m≤n |
5.下列反应的离子方程式正确的是( )
| A. | 碳酸氢钙溶液中加入过量氢氧化钠溶液:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O | |
| B. | 25mL 0.3mol•L-1的FeBr2溶液中通入224mL标准状况下的氯气:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- | |
| C. | 100mL 0.1mol•L-1的Al2(SO4)3溶液中加入20mL 3.5mol•L-1的NaOH溶液:Al3++4OH-═[Al(OH)4]- | |
| D. | 过量铁粉和稀硝酸反应:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O |
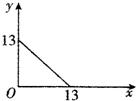 某温度(t℃)下的溶液中,c(H+)=10-xmol•L-1,c(OH-)=10-ymol•L-1,x与y的关系如图所示.请回答下列问题:
某温度(t℃)下的溶液中,c(H+)=10-xmol•L-1,c(OH-)=10-ymol•L-1,x与y的关系如图所示.请回答下列问题: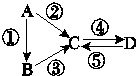 A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如图的反应关系:
A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如图的反应关系: 已知:3Fe(s)+4H2O(g)?Fe3O4(S)+4H2(g),某温度下其平衡常数k=1.在该温度时,在体积为5L的密闭容器中加入3mol Fe(s)与2mol H2O(g),t1秒时测得H2的物质的量为0.70mol.(计算时不用化简)
已知:3Fe(s)+4H2O(g)?Fe3O4(S)+4H2(g),某温度下其平衡常数k=1.在该温度时,在体积为5L的密闭容器中加入3mol Fe(s)与2mol H2O(g),t1秒时测得H2的物质的量为0.70mol.(计算时不用化简)