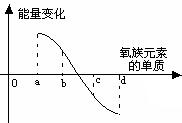
题目内容
A、B、C、D均是短周期元素,A和B同周期, B和C同族,A元素族序数是周期数的三倍,B原子最外层电子数是内层电子数的二倍,B与A能生成化合物BA2,C与A生成化合物CA2, A的阴离子与D的阳离子电子层结构相同,都与氖原子的电子层结构相同,D 的单质与A 的单质在不同条件下反应,可生成D2A或D2A2。请回答
(1)写出元素符号A: ,B: ,C: 。
(2)D2A的电子式 ,BA2的结构式 。
(3)D2A2的化学式 ,灼烧这化合物火焰呈 色。
(4)C在元素周期表中的位置是 ,其原子结构示意图为 。
(5)比较A、B气态氢化物的沸点 ;原因 。
(1)写出元素符号A: ,B: ,C: 。
(2)D2A的电子式 ,BA2的结构式 。
(3)D2A2的化学式 ,灼烧这化合物火焰呈 色。
(4)C在元素周期表中的位置是 ,其原子结构示意图为 。
(5)比较A、B气态氢化物的沸点 ;原因 。
(1) O, C, Si;(2)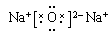 ;O=C=O;(3)Na2O2; 黄色;
;O=C=O;(3)Na2O2; 黄色;
(4)第三周期IVA族,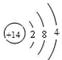 (5)H2O > CH4 , 水分子间形成氢键,加大分子间作用力
(5)H2O > CH4 , 水分子间形成氢键,加大分子间作用力
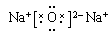 ;O=C=O;(3)Na2O2; 黄色;
;O=C=O;(3)Na2O2; 黄色;(4)第三周期IVA族,
 (5)H2O > CH4 , 水分子间形成氢键,加大分子间作用力
(5)H2O > CH4 , 水分子间形成氢键,加大分子间作用力试题分析:(1)根据题意可知:A是O;B是C;C是Si; D是Na。(2)Na2O的电子式是
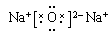 ;CO2的结构式是O=C=O;(3)D2A2是Na2O2,由于该化合物含有Na 元素,所以在灼烧时使火焰呈黄色。(4)Si是14号元素,在元素周期表中位于第三周期IVA族,其原子结构示意图为
;CO2的结构式是O=C=O;(3)D2A2是Na2O2,由于该化合物含有Na 元素,所以在灼烧时使火焰呈黄色。(4)Si是14号元素,在元素周期表中位于第三周期IVA族,其原子结构示意图为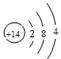 ;(5)两种元素形成的都是共价化合物,分子间通过分子间作用力结合,因此熔沸点较低。但是由于元素的非金属性O>C,原子半径C>O,所以在水的分子之间还存在氢键,增加了分子之间的相互作用力,故这两种元素的气态氢化物的沸点H2O > CH4。
;(5)两种元素形成的都是共价化合物,分子间通过分子间作用力结合,因此熔沸点较低。但是由于元素的非金属性O>C,原子半径C>O,所以在水的分子之间还存在氢键,增加了分子之间的相互作用力,故这两种元素的气态氢化物的沸点H2O > CH4。
练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
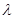 与光的频率v的关系为
与光的频率v的关系为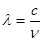 ,其中光速c=3×108m·s-1。根据下表有关蛋白质分子中重要化学键的信息,求波长为300 nm的紫外光的光子所具有的能量 kJ·mol-1,说明人体长时间照射紫外光后皮肤是否会受伤害的原因:
,其中光速c=3×108m·s-1。根据下表有关蛋白质分子中重要化学键的信息,求波长为300 nm的紫外光的光子所具有的能量 kJ·mol-1,说明人体长时间照射紫外光后皮肤是否会受伤害的原因: