题目内容
【题目】I、从古至今,铁及其化合物在人类生产生活中的作用发生了巨大变化。
(1)已知:Fe3O4(s) + CO(g)=3FeO(s) + CO2(g)ΔH1= +19.3 kJ·mol-1
3FeO(s) + H2O(g)=Fe3O4(s) + H2(g)ΔH2= -57.2 kJ·mol-1
C(s) + CO2(g)=2 CO(g)ΔH3= +172.4 kJ·mol-1
写出以铁氧化物为催化剂裂解水制氢气总反应的热化学方程式___________。
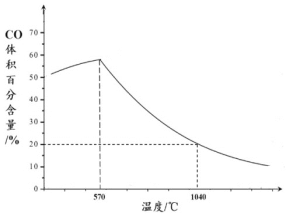
(2)下图表示其它条件一定时,Fe3O4(s)和CO(g)反应达平衡时CO(g)的体积百分含量随温度的变化关系。
①当温度低于570℃时,温度降低,CO的转化率__________(填“增大”、“减小”或“不变”),理由是_______________。
②当温度高于570℃时,随温度升高,反应Fe3O4(s) + CO(g)![]() 3FeO(s) + CO2(g)平衡常数的变化趋势是_________;(填“增大”、“减小”或“不变”);1040℃时,该反应的化学平衡常数的数值是____________。
3FeO(s) + CO2(g)平衡常数的变化趋势是_________;(填“增大”、“减小”或“不变”);1040℃时,该反应的化学平衡常数的数值是____________。
II、汽车尾气中CO、NOx以及燃煤废气中的SO2都是大气污染物,对它们的治理具有重要意义。
(1)吸收SO2和NO,获得Na2S2O4和NH4NO3产品的流程图如图所示(Ce为铈元素)。
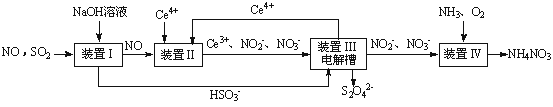
装置Ⅱ中,酸性条件下NO被Ce4+氧化的产物主要是NO3-和NO2-,请写出生成NO3-和NO2-物质的量之比为2:1时的离子方程式:________________________。
(2)装置Ⅲ的作用之一是用质子交换膜电解槽电解使得Ce4+再生,再生时生成的Ce4+在电解槽的____(填“阳极”或“阴极”),同时在另一极生成S2O42-的电极反应式为_________。
(3)已知进入装置Ⅳ的溶液中NO2-的浓度为a g·L-1,要使1.5 m3该溶液中的NO2-完全转化为NH4NO3,至少需向装置Ⅳ中通入标准状况下的氧气___L(用含a代数式表示,结果保留整数,否则不给分)。
【答案】C(s) + H2O(g) = H2(g) + CO(g)ΔH= + 134.5 kJ·mol-1 增大 理由:当温度低于570℃时,温度降低,CO的体积百分含量降低,可逆反应Fe3O4(s)+4CO(g)![]() 3Fe(s)+4CO2(g)正向移动,故CO的转化率增大 增大 4 3NO+5H2O+7Ce4+=2NO3-+NO2-+10H++7Ce3+ 阳极 2H++2HSO3-+2e-=S2O42-+2H2O 365a
3Fe(s)+4CO2(g)正向移动,故CO的转化率增大 增大 4 3NO+5H2O+7Ce4+=2NO3-+NO2-+10H++7Ce3+ 阳极 2H++2HSO3-+2e-=S2O42-+2H2O 365a
【解析】
(1) ①Fe3O4(s) + CO(g)=3FeO(s) + CO2(g)ΔH1= +19.3 kJ·mol-1,
②3FeO(s) + H2O(g)=Fe3O4(s) + H2(g)ΔH2= -57.2 kJ·mol-1,
③C(s) + CO2(g)=2 CO(g)ΔH3= +172.4 kJ·mol-1,根据盖斯定律分析,由①+②+③可得热化学方程式为: C(s) + H2O(g) = H2(g) + CO(g)ΔH=+19.3-57.2+172.4= + 134.5 kJ·mol-1。 (2) ①从图分析,温度低于570℃时,可以看出温度降低,一氧化碳的百分含量减小,可逆反应Fe3O4(s)+4CO(g)![]() 3Fe(s)+4CO2(g)正向移动,故CO的转化率增大。②当温度高于570℃时,随温度升高,一氧化碳的百分含量减小,说明反应Fe3O4(s) + CO(g)
3Fe(s)+4CO2(g)正向移动,故CO的转化率增大。②当温度高于570℃时,随温度升高,一氧化碳的百分含量减小,说明反应Fe3O4(s) + CO(g)![]() 3FeO(s) + CO2(g)正向移动,则平衡常数增大。1040℃时,假设起始加入一氧化碳的物质的量为1mol/L,则
3FeO(s) + CO2(g)正向移动,则平衡常数增大。1040℃时,假设起始加入一氧化碳的物质的量为1mol/L,则
Fe3O4(s) + CO(g)![]() 3FeO(s) + CO2(g)
3FeO(s) + CO2(g)
0
x x
1-x x
有1-x/(1-x+x)=20%,则x=0.8mol/L,平衡常数为0.8/0.2=4。II、(1)假设一氧化氮的物质的量为3mol则根据题意生成2mol硝酸根离子和1mol亚硝酸根离子,则转移7mol电子,从图分析,Ce4+变为Ce3+,则需要Ce4+的物质的量为7mol,根据此数据书写离子方程式为:3NO+5H2O+7Ce4+=2NO3-+NO2-+10H++7Ce3+。 (2) 再生时生成的Ce4+的过程为化合价升高,即失去电子,所以该反应在阳极进行。同时另一极生成S2O42-是亚硫酸氢根离子得到电子,电极反应为: 2H++2HSO3-+2e-=S2O42-+2H2O。(3)从图分析,反应过程中亚硝酸根离子化合价升高,氧气化合价降低,根据电子守恒分析,氧气的体积为![]() =365aL。
=365aL。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案




