题目内容
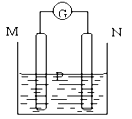
【题目】下图所示装置中观察到电流计指针偏转,M棒变粗,N棒变细,指针指向M,由此判断下表中所列M、N、P物质,其中可以成立的是( )
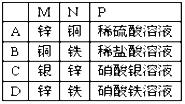
A. AB. BC. CD. D
【答案】C
【解析】
电流计指针偏转,M棒变粗,N棒变细,指针指向M,这说明构成原电池,原电池中,负极材料比正极材料活泼,且负极材料是随着反应的进行质量减少,正极材料增加或放出气泡,根据题意可知,N极是负极,M极是正极,且N极材料比M极活泼,据此分析解答。
A.M是锌作负极,溶液中的氢离子放电,故A错误;
B.铜是正极,但溶液中的氢离子放电,电极质量不变,故B错误;
C.银是正极,溶液中的银离子放电,质量增加。锌是负极,锌失去电子,质量减少,故C正确;
D.锌是负极,铁是正极,溶质的铁离子放电转化为亚铁离子,故D错误。
答案选C。

练习册系列答案
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案
相关题目