题目内容
【题目】已知A、B、C、D、E代表五种元素。A元素的三价离子3d能级处于半充满;B元素原子的最外层电子数是内层电子总数的2倍;C的原子轨道中有2个未成对的电子,且与B可形成两种常见的气体;D的原子序数小于A,D与C可形成DC2和DC3两种分子,且DC2是极性分子,DC3是非极性分子;E是短周期元素中除了稀有气体外原子半径最大的元素。试回答下列问题:
(1)写出A元素基态原子的电子排布式。
(2)B、C、D三种元素的电负性由大到小的顺序为(写元素符号)。
(3)E与C以1:1形成的物质的电子式为。
(4)用VSEPR理论判断DC3分子的空间立体结构为。
(5)元素周期表中第一电离能最大的元素是(填元素符号)。
【答案】
(1)1s22s22p63s23p63d64s2
(2)O>S>C
(3)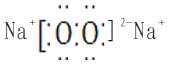
(4)正三角形
(5)He
【解析】A元素的三价离子3d能级处于半充满,即为3d5 , 则它的原子价电子构型为3d64s2 , 故为Fe元素;由“B元素原子的最外层电子数是内层电子总数的2倍”推出,B为C元素;由“C的原子轨道中有2个未成对的电子,且与B可形成两种常见的气体”推出,C为O元素;由“D的原子序数小于A,D与C可形成DC2和DC3两种分子,且DC2是极性分子,DC3是非极性分子”推出,D为S元素;由“E是短周期元素中除了稀有气体外原子半径最大的元素”可推出,E为Na元素。(1)A元素基态原子的电子排布式为1s22s22p63s23p63d64s2。(2)B、C、D分别对应的是C、O、S元素,它们的电负性由大到小的顺序为O>S>C。(3)E与C以1:1形成的物质是Na2O2。(4)根据VSEPR理论 ![]() =3,故SO3的空间立体结构为正三角形。(5)在元素周期表中第一电离能最大的元素是He。
=3,故SO3的空间立体结构为正三角形。(5)在元素周期表中第一电离能最大的元素是He。