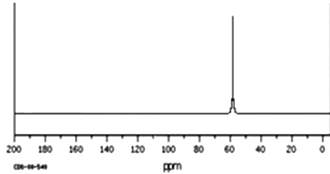
��Ŀ����
����Ŀ�������й�ʵ��ԭ���������ͽ��۶���ȷ���ǣ� ��
A.��FeCl3��Һ�еμӹ�����ˮ������ȡFe��OH��3����
B.ȡ������ҺX�������м�������������ˮ���ټӼ���KSCN��Һ����Һ��죬˵��X��Һ��һ������Fe2+
C.��ij��ɫ��Һ�м���ϡ�����������ټ���BaCl2��Һ������ɫ������֤����SO42��
D.��֪I3��![]() I2+I�� �� ��ʢ��KI3��Һ���Թ��м�������CCl4 �� ���ú�CCl4������ɫ��˵��KI3��CCl4�е��ܽ�ȱ���ˮ�еĴ�
I2+I�� �� ��ʢ��KI3��Һ���Թ��м�������CCl4 �� ���ú�CCl4������ɫ��˵��KI3��CCl4�е��ܽ�ȱ���ˮ�еĴ�
���𰸡�C
��������
A����FeCl3��Һ�еμӹ�����ˮ�õ�����Fe(OH)3���������ǽ��壬A��������⣻
B������û���ȼ�KSCN��Һ��ֱ�Ӽ�����ˮ�����Բ���ȷ��ԭ��Һ����Fe2+����Fe3+ �� B��������⣻
C������Һ�к���Ag�� �� �����BaCl2��Һ��Ҳ�������ɫ������C��ij��ɫ��Һ�м���ϡ�����������ټ���BaCl2��Һ������ɫ������֤����SO42����C��������⣻
D��ʹCCl4������ɫ����I2 �� ������I3- �� ����˵��I2��CCl4���е��ܽ�ȴ�D��������⣻
��ѡC��
A���õ�����Fe(OH)3���������ǽ���
B����ˮ��ǿ�����ԻὫFe2+������Fe3+ �� ���ȼ�KSCN������Fe3+�����ٵμ���ˮ��죨��Fe2+ת��ΪFe3+��
C������BaCl2��Һ���в�ͬ���������ᱵ���Ȼ�����̼�ᱵ�ȣ��������ȼ�HCl��������ų��������Ӹ��ţ��ټ�BaCl2��Һ����SO42��
D��ʹCCl4������ɫ����I2 �� ��KI3�ء�ֻ��˵��I2�������л��ܼ�

����Ŀ������̼������Ҫ�ķǽ���Ԫ�أ�������̼Ԫ�ص������ڹ�ҵ����������Ҫ��Ӧ�ã�
��1����д����ҵ����NH3��ȡNO�Ļ�ѧ����ʽ ��
��2��һ�������£������Ժ�CO2������Ӧ��Fe��s��+CO2��g��FeO��s��+CO��g������֪�÷�Ӧ��ƽ�ⳣ��K���¶�T�Ĺ�ϵ��ͼ��ʾ��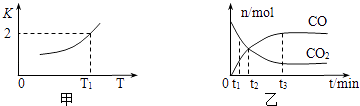
�ٸ÷�Ӧ���淴Ӧ��������ȡ����ȡ�����Ӧ��
��T�桢P paѹǿ�£������ΪVL�������н��з�Ӧ��������˵����Ӧ�ﵽƽ��״̬���� ��
A����������ƽ����Է����������ٱ仯��
B��������ѹǿ���ٱ仯��
C��v����CO2��=v����FeO��
��T1�¶��£������ΪV L���ܱ������м����������۲�����һ������CO2 �� ��Ӧ������CO��CO2���ʵ�����ʱ��Ĺ�ϵ��ͼ����ʾ����CO2��ƽ��ת����Ϊ �� ƽ��ʱ���������ܶ�����ʼʱ������ܶ�֮��Ϊ ��
��3���ں��������£���ʼʱ�ݻ���Ϊ5L�ļס������ܱ������У���Ϊ������������Ϊ��ѹ�������������з�Ӧ��N2+3H22NH3 �� �й����ݼ�ƽ��״̬�ض�������
���� | ��ʼͶ�� | ��ƽ��ʱ | |||
�� | 2mol N2 | 3mol H2 | 0mol NH3 | 1.5mol NH3 | ͬ�����ʵ����������ͬ |
�� | a mol N2 | b mol H2 | 0mol NH3 | 1.2mol NH3 | |
��ʼʱ�������е�ѹǿ�Ǽ�����������
��4��һ�������£�2.24L������Ϊ��״����N2O��CO�Ļ�������ڵ�ȼ����ǡ����ȫ��Ӧ���ų�bkJ���������ɵ�3�ֲ����Ϊ����������壬����÷�Ӧ��������ܶ��Ƿ�Ӧǰ�����ܶȵ� ![]() ������д���÷�Ӧ���Ȼ�ѧ����ʽ ��
������д���÷�Ӧ���Ȼ�ѧ����ʽ ��