题目内容
【题目】(1)下列关于H2S和SO2的说法正确的是______________
A.两气体都可用浓硫酸干燥
B.两气体均可以用NaOH溶液吸收
C.两气体按体积比1:2 混合可完全转化为S
D.将两气体通入溴水或酸性KMnO4溶液中,可通过颜色变化鉴别两气体
(2)目前治理汽车尾气是在催化剂条件下发生反应2NO+2CO![]() N2+2CO2,现在实验室模拟上述反应,己知在t℃时在2L恒容密闭容器中加入2 molNO和1mol CO气体,经l0min达到平衡,测得此时CO2的体积分数为1/7,回答下列问题:
N2+2CO2,现在实验室模拟上述反应,己知在t℃时在2L恒容密闭容器中加入2 molNO和1mol CO气体,经l0min达到平衡,测得此时CO2的体积分数为1/7,回答下列问题:
①这段时间内CO的反应速率为_________________ 。
②该反应平衡常数______________(保留两位有效数字)。
③平衡后再向密闭容器通入0.4molCO和0.4molCO2,平衡将_____________(填“正向”、“逆向”或“不”)移动。判断理由是_________________。
④若升温发现体系气体平均相对分子质量增大,则该反应的△H______0(填“>”、“<”或“=”)。
⑤维持条件不变,向平衡后的容器再充入0.2molNO和0.1molCO,达到新平衡,则与原平衡相比NO的转化率____________ (填“增大”、“减小”或“不变”)。
【答案】 B 0.02moI/L/min 0.069 逆向 通入气体后Qc大于平衡常数,故平衡逆向移动 > 增大
【解析】(1)H2S具有还原性,不能用浓硫酸干燥,A项错误;H2S和SO2均能与NaOH溶液反应,B项正确;2H2S+ SO2=3S↓+ H2O,两气体按体积比2:1 混合可完全转化为S,C项错误;H2S和SO2均能与溴水或酸性KMnO4溶液反应,故不能通过颜色变化鉴别两气体,D项错误;(2)根据题意列三段式可知:
2NO + 2CO ![]() N2 + 2CO2
N2 + 2CO2
c起始(mol/L) 1 0.5 0 0
c变化(mol/L) 2x 2x x 2x
c平衡(mol/L) 1-2x 0.5-2x x 2x
由达到平衡,测得此时CO2的体积分数为1/7,可得: ![]() ,解得x= 0.1mol/L,①
,解得x= 0.1mol/L,①![]() =0.02moI/(Lmin);②
=0.02moI/(Lmin);②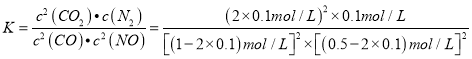 =0.069L/mol;③平衡后再向密闭容器通入0.4molCO和0.4molCO2,此时各物质的浓度分别为c(NO)=0.8mol/L、c(CO)=0.5mol/L、c(N2)=0.1mol/L、c(CO2)=0.4mol/L,则
=0.069L/mol;③平衡后再向密闭容器通入0.4molCO和0.4molCO2,此时各物质的浓度分别为c(NO)=0.8mol/L、c(CO)=0.5mol/L、c(N2)=0.1mol/L、c(CO2)=0.4mol/L,则
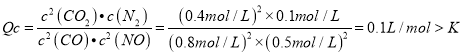 ,故平衡逆向移动;④根据
,故平衡逆向移动;④根据![]() 可知,都是气体,m为不变量,升高温度,
可知,都是气体,m为不变量,升高温度, ![]() 增大,说明n减小,即向正反应方向移动,结合升高温度,平衡向吸热的方向移动,故正反应为吸热,即△H>0;⑤维持条件不变,向平衡后的容器再充入0.2molNO和0.1molCO,达到新平衡,即相当于原平衡基础上增大压强,平衡正向移动,故NO的转化率增大。
增大,说明n减小,即向正反应方向移动,结合升高温度,平衡向吸热的方向移动,故正反应为吸热,即△H>0;⑤维持条件不变,向平衡后的容器再充入0.2molNO和0.1molCO,达到新平衡,即相当于原平衡基础上增大压强,平衡正向移动,故NO的转化率增大。