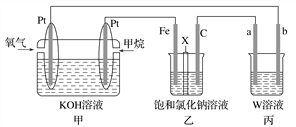
题目内容
【题目】下列说法正确的是:
A.把NaHCO3和Na2CO3混和物6.85 g溶于水制成100 mL溶液,其中c(Na+)=1 mol·L-1,该溶液中加入一定量盐酸恰好完全反应,将溶液蒸干后,所得固体质量无法计算
B.将54.4 g铁粉和氧化铁的混合物中加入4.0mol/L200 mL的稀硫酸,恰好完全反应,放出氢气4.48 L(标准状况),反应后的溶液中滴加KSCN不显红色,且无固体剩余物,反应后得到FeSO4的物质的量是0.8mol
C.现向一密闭容器中充入1mol N2和3mol H2,在一定条件下使该反应发生,达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等
D.某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42+ 等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示,由此可知,该溶液中肯定含有的阳离子是H+、NH4+、Mg2+、Al3+

【答案】B
【解析】
试题分析:A、溶液中加入一定量盐酸恰好完全反应,所得溶液为氯化钠,最后所得固体为氯化钠,根据钠离子守恒由n(NaCl)=n(Na+)=0.1L×1mol/L=0.1mol,故氯化钠的质量为0.1mol×58.5g/mol=5.85g,故A错误;B、硫酸恰好完全反应,反应后的溶液中滴加KSCN不显红色,且无固体剩余物,最后为硫酸亚铁溶液,根据硫酸根守恒可知n(FeSO4)=n(H2SO4)=4.0mol/L×0.2L=0.8mol,故B正确;C、开始投入1molN2和3molH2,氮气与氢气按1:3反应二者转化率相同,平衡时氮气与氢气物质的量浓度为1:3,不可能相等,故C错误;D、开始加入NaOH没有沉淀和气体产生,则一定有H+,后来有沉淀产生且最后消失,则一定没有Mg2+、Fe3+,一定有Al3+;中间段沉淀的质量不变,应为NH4++OH-=NH3H2O的反应,则有NH4+,根据电荷守恒可知一定有SO42-,故D错误;故选B。

 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
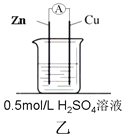
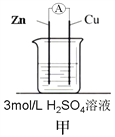
金状元绩优好卷系列答案【题目】为了探究影响化学反应速率的因素,现设计如图所示两组对比试验
第1组 | 第2组 |
|
|
(1)第1组:实验目的是探究________对化学反应速率的影响。
(2)第2组:甲中电流表指针偏转程度更大,说明反应物浓度越大,化学反应速率_____。
(3)第2组甲中能量转化的形式是______________(填“电能转化为化学能”或“化学能转化为电能”),锌片________(填“失去”或“得到”)电子,当放出3.36L(标准状况)气体时,理论上消耗的锌的质量是________g,通过导线的电子有___________mol 。