题目内容
【题目】Ⅰ. CH3OH是一种无色有刺激性气味的液体,在生产生活中有重要用途,同时也是一种重要的化工原料。
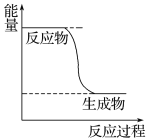
(1)已知CH3OH(g)+1/2O2(g) ![]() CO2(g)+2H2(g)的能量变化如图所示,下列说法正确的是______(填字母)。
CO2(g)+2H2(g)的能量变化如图所示,下列说法正确的是______(填字母)。
a.CH3OH转变成H2的过程是一个吸收能量的过程
b.H2的生成速率与CH3OH的消耗速率之比为1∶2
c.化学变化不仅有新物质生成,同时也一定有能量变化
d.1 mol H—O键断裂的同时2 mol C===O键断裂,则反应达最大限度
(2)某温度下,将5molCH3OH和2molO2充入2L的密闭容器中,经过4min反应达到平衡,测得c(O2)=0.2mol·L-1,4min内平均反应速率v(H2)=________________,则CH3OH的转化率为___________。
Ⅱ.在恒温条件下将一定量X和Y的混合气体通入一容积为2 L的密闭容器中,X和Y两物质的浓度随时间变化情况如下图。
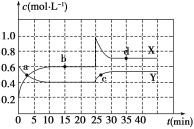
(1)该反应的化学方程式为(反应物或生成物用符号X、Y表示)______________________________。
(2)a、b、c、d四个点中,表示化学反应处于平衡状态的点是___________。
Ⅲ.当电极a为Al,电极b为Mg,电解质溶液为氢氧化钠溶液时,该电池的正极为________,负极的电极反应式为_______________________________。当反应中收集到标准状况下224 mL气体时,消耗的a电极质量为________g。
【答案】cd 0.8 mol·L-1·min-1 64% Y![]() 2X bd Mg Al-3e-+4OH-= AlO2-+2H2O 0.18
2X bd Mg Al-3e-+4OH-= AlO2-+2H2O 0.18
【解析】
(1)从所给图示判断出该反应为放热反应。(2)利用化学反应速率定义式和转化率的定义式进行直接计算。(3)从图示中找出两种物质的变化配比,写出可逆反应方程式。
I.(1)由图可知,反应物总能量大于生成物总能量,反应为放热反应,a项错误;
化学反应速率之比等于化学计量数之比,氢气生成速率与甲醇消耗速率之比为2:1,b项错误;
物质不同,含有的能量不同,物质改变,能量必然变化,所以任何化学反应,在发生物质变化的同时,必伴随着能量的变化,c项正确;
当有1 mol H-O键断裂的同时2 mol C=O键断裂,说明V正=V逆,即可逆反应达到了平衡,d项正确;所以答案选择cd项;
(2)平衡时氧气浓度为0.2mol·L-1,则O2反应消耗的量为:2mol-2L×0.2mol·L-1=1.6mol,甲醇消耗的量为3.2mol,则生成氢气的量为:1.6mol×4=6.4mol,故v(H2)=(6.4mol÷2L)÷8min=0.8mol·L-1·min-1;甲醇的转化率为(3.2mol÷5mol)×100%=64%;
II.(1)由0~25min两种物质浓度变化可知消耗0.8mol的X可生成0.4mol的Y,则反应方程式为:Y![]() 2X;
2X;
(2)观察图示可以看出,b、d两点物质浓度不再发生变化,反应处于平衡状态;
III.注意电解质为氢氧化钠溶液,则反应物质为铝,作负极,该电池的正极为Mg;负极铝的电极反应式为:Al-3e-+4OH-= AlO2-+2H2O;标准状况下224mL气体的物质的量为0.01mol,根据反应方程式2Al+2NaOH+2H2O=2NaAlO2+3H2↑,可计算出消耗的铝的物质的量为0.01÷3×2mol,其质量为27g/mol×0.01÷3×2mol=0.18g。

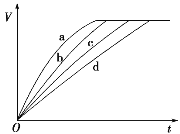
【题目】等质量的铁与过量的盐酸在不同的实验条件下进行反应,测得在不同时间(t)内产生气体体积(V)的数据如图所示,根据图示分析实验条件,下列说法中一定不正确的是( )
组别 | 对应曲线 | c(HCl)/ mol·L-1 | 反应温度/℃ | 铁的状态 |
1 | a | 30 | 粉末状 | |
2 | b | 30 | 粉末状 | |
3 | c | 2.5 | 块状 | |
4 | d | 2.5 | 30 | 块状 |
A. 第4组实验的反应速率最慢B. 第1组实验中盐酸的浓度大于2.5 mol·L-1
C. 第2组实验中盐酸的浓度等于2.5 mol·L-1D. 第3组实验的反应温度低于30 ℃