题目内容
干电池的负极反应是:Zn –2e = Zn 2+,现以干电池作电源电解32.4g 34%的硝酸钾溶液,一段时间后,测得溶液中溶质的质量分数为36%,则干电池中消耗锌的物质的量为
| A.0.3mol | B.0.05mol | C.0.2mol | D.0.1mol |
D
试题分析:惰性电极电解硝酸钾溶液,实质是电解水。设反应后溶液的质量是m,则根据溶质不变可知,32.4g×34×=m×36%,解得m=30.06g,所以被电解的水的质量是32.4g-30.06g=1.8g,物质的量是0.1mol。则根据2H2O
 2H2↑+O2↑可知,电解0.1mol水转移电子的物质的量是0.1mol×2=0.2mol,则根据电子得失守恒可知,消耗锌的物质的量是0.2mol÷2=0.1mol,答案选D。
2H2↑+O2↑可知,电解0.1mol水转移电子的物质的量是0.1mol×2=0.2mol,则根据电子得失守恒可知,消耗锌的物质的量是0.2mol÷2=0.1mol,答案选D。点评:该题是中等难度的试题,试题综合性强,侧重对学生能力的培养与基础知识的巩固与训练,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力。该题的关键是明确电解产物的判断,然后依据电子得失守恒直接列式计算即可。

练习册系列答案
相关题目
 O2(g)=CO(g)+2H2(g) △H2=-35.4 kJ·mol-1
O2(g)=CO(g)+2H2(g) △H2=-35.4 kJ·mol-1 [Cu(NH3)3]Ac·CO △H<0
[Cu(NH3)3]Ac·CO △H<0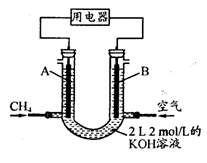
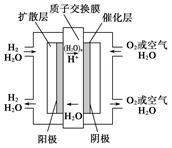
 2H2O
2H2O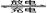 2Pb2++2H2O。若充放电过程中电解质溶液的体积变化忽略不计,下列有关新型液流式铅酸蓄电池的说法正确的是
2Pb2++2H2O。若充放电过程中电解质溶液的体积变化忽略不计,下列有关新型液流式铅酸蓄电池的说法正确的是