题目内容
19.下列说法正确的是( )| A. | SiH4比CH4稳定 | |
| B. | O2-半径比F-的小 | |
| C. | Na和Cs属于第ⅠA族元素,Cs失电子能力比Na的强 | |
| D. | 酸性 HClO4>H2SO4>CH3COOH>H2CO3 |
分析 A、原子的得电子能力越强,则其氢化物的稳定性越强;
B、核外电子数相同,核内质子数越多半径越小;
C、同一主族从上到下原子的失电子能力逐渐增强;
D、原子的得电子能力越强则最高价氧化物对应的水化物的酸的酸性越强.
解答 解:A、原子的得电子能力C>Si,则其氢化物的稳定性SiH4<CH4,故A错误;
B、O2-和F-核外电子数相同,核内质子数越多半径越小,即O2-半径比F-的大,故B错误;
C、同一主族从上到下原子的失电子能力逐渐增强,所以Cs失电子能力比Na的强,故C正确;
D、原子的得电子能力:Cl>S>C,则最高价氧化物对应的水化物的酸的酸性HClO4>H2SO4>H2CO3,由所学知识知,醋酸为弱酸,且酸性强于碳酸,即酸性HClO4>H2SO4>CH3COOH>H2CO3,故D正确.故选CD.
点评 本题考查元素周期表的性质递变规律,掌握元素的非金属性以及金属性递变规律是解决本题的关键,涉及氢化物稳定性、最高价氧化物水化物酸性、离子半径等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.下列选择的条件符合勒夏特列原理的是( )
| A. | 硫酸工业中合成三氧化硫采用常压条件 | |
| B. | 合成氨工业采用高压 | |
| C. | 硫酸工业选用浓硫酸吸收三氧化硫 | |
| D. | 合成氨工业采用500度左右的温度 |
7.某物质中可能有甲酸、乙酸、甲醇和甲酸乙酯四种物质中的一种或几种.在鉴定时有下列现象:①有银镜反应;②加入新制的Cu(OH)2 悬浊液后未发现变澄清;③与含酚酞的NaOH溶液共热,红色逐渐消失.下列结论正确的是( )
| A. | 有甲酸乙酯,可能有甲醇 | B. | 有甲酸乙酯和甲酸 | ||
| C. | 有甲酸乙酯和甲醇 | D. | 几种物质均存在 |
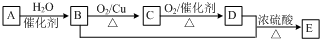
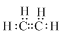 ;欲鉴别A与甲烷可选择溴水或酸性高锰酸钾溶液作试剂.
;欲鉴别A与甲烷可选择溴水或酸性高锰酸钾溶液作试剂.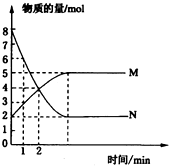 在一定温度下,将两种气体M和N通入容积为2L的密闭容器中进行反应,M和N的物质的量与时间的关系如图所示.
在一定温度下,将两种气体M和N通入容积为2L的密闭容器中进行反应,M和N的物质的量与时间的关系如图所示.