题目内容
【题目】I.下列物质:①N2 ②CO2 ③NH3 ④Na2O ⑤Na2O2 ⑥NaOH ⑦CaBr2 ⑧H2O2 ⑨NH4Cl ⑩HBr。
I.含有极性键和非极性键的是___________________;含有非极性键的离子化合物是____________。(均填序号)
II.下表为元素周期表的一部分,请参照元素①一⑨在表中的位置,用化学用语回答下列问题:
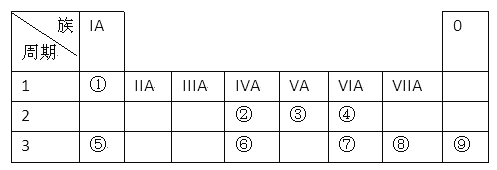
(1)在①~⑨元素中,金属性最强的元素是_____________,化学性质最稳定的元素是________________。(均填元素符号)
(2)元素⑦与元素⑧相比,⑧的非金属性较强,下列表述中能证明这一事实的是____________。
a.常温下⑦的单质和⑧的单质状态不同
b.⑧的氢化物比⑦的氢化物稳定
c.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应
d.⑦的氧化物的水化物比⑧的氧化物的水化物酸性弱
请设计一个实验,证明元素②与元素⑥的非金属性强弱,只写出反应的化学方程式(不写实验步骤)_____________________________________________________。
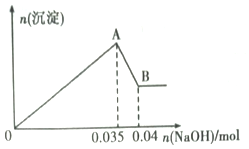
(3)⑧构成的单质通入一定浓度的苛性钾溶液中,两者恰好完全反应(该反应为放热反应),生成物中三种含Y 元素的离子,其中两种离子物质的量(n) 与反应时间(t) 的变化如图所示,写出该反应的离子方程式是_______________________________________________。

【答案】 ⑧ ⑤ Na Ar b Na2SiO3+CO2+H2O=Na2CO3+H2SiO3或Na2SiO3+2CO2+2H2O=2NaHCO3+H2SiO3↓ 5Cl2+10OH-=2C1O-+C1O3-+7Cl-+5H2O
【解析】I.①N2中只含非极性键,属于单质;②![]() 、③
、③![]() 、⑩HBr中只含极性键,属于共价化合物;⑧
、⑩HBr中只含极性键,属于共价化合物;⑧![]() 含有
含有![]() 极性键和
极性键和![]() 非极性键,属于共价化合物;⑤
非极性键,属于共价化合物;⑤![]() 中含有离子键和非极性键,属于离子键化合物;⑥NaOH、⑨
中含有离子键和非极性键,属于离子键化合物;⑥NaOH、⑨![]() 中含有离子键和极性键,属于离子键化合物;⑦
中含有离子键和极性键,属于离子键化合物;⑦![]() 、④
、④![]() 中只含离子键,属于离子化合物;含有极性键和非极性键的是⑧;含有非极性键的离子化合物是⑤;正确答案:⑧;⑤。
中只含离子键,属于离子化合物;含有极性键和非极性键的是⑧;含有非极性键的离子化合物是⑤;正确答案:⑧;⑤。
II.由元素在周期表中位置可以知道(1)为H、(2)为C、(3)为N、(4)为O、(5)为Na、(6)为Si、(7)为S、(8)为Cl、(9)为Ar。
(1)在①~⑨元素中,金属性最强的元素是Na;化学性质最稳定的元素是Ar;正确答案:Na; Ar。
(2)a.单质状态属于物理性质,不能比较非金属性强弱,a错误;![]() 的氢化物比(7)的氢化物稳定,说明(8)的非金属性更强,b正确; c.单质与氢氧化钠溶液反应不能比较非金属性强弱,c错误;d.不是最高氧化物对应水化物的酸性强弱比较,不能说明元素非金属性强弱,d错误;证明元素C与元素Si的非金属性强弱,可以用碳酸的酸性大于硅酸的酸性进行比较,把二氧化碳通入硅酸钠溶液中产生白色沉淀,方程式为Na2SiO3+CO2+H2O=Na2CO3+H2SiO3或Na2SiO3+2CO2+2H2O=2NaHCO3+H2SiO3↓;正确选项:b ;Na2SiO3+CO2+H2O=Na2CO3+H2SiO3或Na2SiO3+2CO2+2H2O=2NaHCO3+H2SiO3↓。
的氢化物比(7)的氢化物稳定,说明(8)的非金属性更强,b正确; c.单质与氢氧化钠溶液反应不能比较非金属性强弱,c错误;d.不是最高氧化物对应水化物的酸性强弱比较,不能说明元素非金属性强弱,d错误;证明元素C与元素Si的非金属性强弱,可以用碳酸的酸性大于硅酸的酸性进行比较,把二氧化碳通入硅酸钠溶液中产生白色沉淀,方程式为Na2SiO3+CO2+H2O=Na2CO3+H2SiO3或Na2SiO3+2CO2+2H2O=2NaHCO3+H2SiO3↓;正确选项:b ;Na2SiO3+CO2+H2O=Na2CO3+H2SiO3或Na2SiO3+2CO2+2H2O=2NaHCO3+H2SiO3↓。
(3)由题意可知三种含Y元素的离子为Cl-,ClO-,![]() ;根据图像可以看出n(ClO-)=0.06mol,n(
;根据图像可以看出n(ClO-)=0.06mol,n(![]() )=0.03 mol,根据电子守恒可知:0.06×1+0.03×5=n(Cl-)×1,所以n(Cl-)=0.21 mol,所以n(Cl-):n(ClO-):n(
)=0.03 mol,根据电子守恒可知:0.06×1+0.03×5=n(Cl-)×1,所以n(Cl-)=0.21 mol,所以n(Cl-):n(ClO-):n(![]() )=0.21:0.06:0.03=7:2:1,所以该反应的离子方程式为5Cl2+10OH-=2C1O-+C1O3-+7Cl-+5H2O;正确答案:5Cl2+10OH-=2C1O-+C1O3-+7Cl-+5H2O。
)=0.21:0.06:0.03=7:2:1,所以该反应的离子方程式为5Cl2+10OH-=2C1O-+C1O3-+7Cl-+5H2O;正确答案:5Cl2+10OH-=2C1O-+C1O3-+7Cl-+5H2O。

 阅读快车系列答案
阅读快车系列答案【题目】下表是部分短周期元素的原子半径及主要化合价,以下叙述正确的是
元素代号 | L | M | Q . | R | T |
原子半径 | 0.160 nm | 0.143 nm | 0.089 nm | 0.102 nm | 0.074 um |
主要化合价 | +2 | + 3 | + 2 | + 6,-2 | -2 |
A. 气态氢化物的稳定性为H2T<H2R
B. 碱性Q(OH)2>L(OH)2
C. M与T形成的化合物可以用作防火材料
D. L2+与R2-的核外电子数相等