题目内容
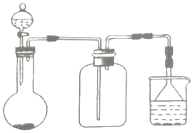
【题目】Ⅰ.如图是中学化学中常用于混合物的分离和提纯的装置,请据此回答:
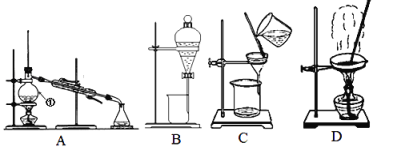
(1)除去自来水中的Cl-等杂质,选择装置____(填字母,下同);从氯化钠与单质碘的混合溶液中提取碘,选择装置_______,该分离方法的名称为____________。
(2)碳酸钙中混有氯化钠晶体,选择装置_____去除 。
(3)从NaCl(大量)和KNO3(少量)的混合溶液中分离出NaCl(晶体)的方法是____、___洗涤、干燥。
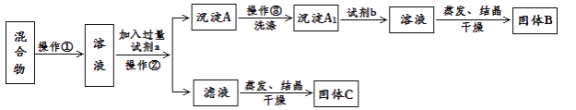
Ⅱ.甲同学设计如下实验方案,以分离KCl和BaCl2的固体混合物,试回答下列问题:
供选择的试剂有:盐酸、硫酸钾溶液、碳酸钾溶液、碳酸钠溶液
(1)操作①的名称是________,操作②的名称是________。
(2)试剂a是________,试剂b是________,固体B化学式________。
(3)加入试剂a所发生的化学反应方程式为:___________。
加入试剂b所发生的化学反应方程式为:____________。
(4)乙同学认为该方案不能达到实验目的,理由是:__________,改进方案为:______________。
【答案】A B 萃取 C 蒸发结晶 趁热过滤 溶解 过滤 K2CO3 HCl BaCl2 K2CO3+BaCl2═BaCO3↓+2KCl BaCO3+2HCl=BaCl2+H2O+CO2↑ 滤液中有过量的CO32-未除去 蒸发前,加入稀盐酸将碳酸钾转化为氯化钾
【解析】
Ⅰ.(1)除去自来水中的Cl-等杂质,可以利用沸点不同分离;碘不易溶于水,易溶于有机溶剂,据此分析解答;
(2)碳酸钙不溶于水,而氯化钠易溶于水;
(3)NaCl和KNO3的溶解度随温度变化不同,可用重结晶的方法分离;
Ⅱ.分离KCl和BaCl2两种固体混合物,先将两种物质溶于水,然后加入过量K2CO3使BaCl2转化为沉淀,则试剂a为K2CO3,过滤后在沉淀中加入盐酸可生成BaCl2溶液,则试剂b为盐酸,经蒸发、结晶、干燥后可得固体BaCl2,操作②所得滤液为KCl和K2CO3的混合物,应加入过量盐酸可得KCl,以此分析解答。
Ⅰ.(1)除去自来水中的Cl-等杂质,可以采用蒸馏的方法,则选择A装置;从氯化钠与碘水的混合溶液中分离出I2,可以加入四氯化碳进行萃取,选择B装置,故答案为A;B;萃取;
(2)碳酸钙中混有氯化钠晶体,碳酸钙难溶于水,而氯化钠易溶于水,可以通过溶解过滤的方法除去碳酸钙中的氯化钠,选择装置C,故答案为C;
(3)NaCl和KNO3的溶解度随温度变化不同,可用重结晶的方法分离,由于含有少量硝酸钾,应使硝酸钾残留在母液中,可用蒸发结晶的方法,趁热过滤分离出氯化钠,故答案为蒸发结晶、趁热过滤;
Ⅱ(1)将固体配成溶液,应加水溶解,操作②为固体和液体的分离,为过滤操作,故答案为溶解;过滤;
(2)固体溶解后加入过量K2CO3使BaCl2转化为沉淀,过滤后沉淀中加入盐酸可生成BaCl2溶液,经蒸发、结晶、干燥后可得固体BaCl2,故答案为K2CO3;HCl;BaCl2;
(3)加入试剂a,K2CO3与BaCl2反应生成BaCO3沉淀,发生的化学方程式为K2CO3+BaCl2═BaCO3↓+2KCl,加入试剂b,BaCO3沉淀加入盐酸可生成BaCl2溶液,反应的化学方程式为BaCO3+2HCl=BaCl2+H2O+CO2↑,故答案为K2CO3+BaCl2═BaCO3↓+2KCl;BaCO3+2HCl=BaCl2+H2O+CO2↑;
(4)滤液为KCl和K2CO3的混合物,蒸发结晶前应加入适量稀盐酸,将过量的碳酸钾转化成氯化钾,故答案为滤液中有过量的CO32-未除去;蒸发前,加入稀盐酸将碳酸钾转化为氯化钾。