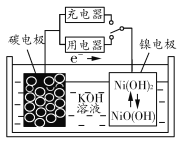
题目内容
【题目】磷化氢(PH3)、氧硫化碳(COS)均可作储粮害虫杀剂。请回答下列问题:
(1)磷原子的核外电子排布式______,核外有___种不同能量的电子;其最外层有___种运动状态不同的电子,这些电子占据的轨道数为___个。
(2)氧硫化碳中,元素的非金属性最强的元素在周期表中的位置是______;已知COS与CO2的结构相似,试写出COS的电子式_______________,COS属于_____分子(填“极性”或“非极性”)。
(3)用硫酸铜溶液吸收PH3时的化学方程式为:
___CuSO4+ PH3+ H2O→ Cu3P↓+ H3PO4+ H2SO4
(4)配平上述方程式,并标出电子转移方向与数目。
上述反应中氧化剂是______,当吸收2.2molPH3转移电子______mol。
氧硫化碳水解及部分应用流程如下(部分产物已略去):
COS![]() H2S
H2S![]() Na2S
Na2S![]() M溶液+H2
M溶液+H2
(5)写出反应II的离子方程式:_________;
(6)若M溶液中硫元素的存在形式为S2O32﹣,则反应Ⅲ的离子方程式为_________。
【答案】 1s22s22p63s23p3 5 5 4 第二周期第VIA族 ![]() 极性
极性 ![]() CuSO4 4.8 H2S+ 2OH- →S2- + 2H2O 2S2﹣+5H2O
CuSO4 4.8 H2S+ 2OH- →S2- + 2H2O 2S2﹣+5H2O![]() S2O32﹣+4H2↑+2OH﹣
S2O32﹣+4H2↑+2OH﹣
【解析】(1)磷的质子数为15,原子的核外电子排布式1s22s22p63s23p3,核外有5种不同能量的电子;各电子的运动状态不同,其最外层有5 个电子,所以5种运动状态不同的电子,这些电子占据的轨道数为1+3=4个,故答案为:1s22s22p63s23p3;5;5;4;
(2)氧硫化碳中,元素的非金属性最强的元素是氧元素,在周期表中的位置为第二周期第ⅥA族;碳原子与氧氧原子、硫原子形成2对共用电子对,COS分子电子式为![]() ,COS分子中正负电荷中心不重合,所以是极性分子,故答案为:第二周期第ⅥA族;
,COS分子中正负电荷中心不重合,所以是极性分子,故答案为:第二周期第ⅥA族;![]() ;极性;
;极性;
(3)1)该方程式中Cu价态由+2→+1,P价态由-3→+5,为保证化合价升降数相等,Cu3P与H3PO4计量数分别为8、3,CuSO4的系数是24,H2SO4系数是24,根据元素守恒,得到:24CuSO4+11PH3+12H2O═8Cu3P↓+3H3PO4+24H2SO4,电子转移数目为: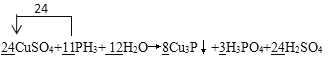 ,故答案为:
,故答案为: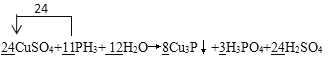 ;
;
2)该方程式中Cu价态由+2→+1,所以氧化剂是硫酸铜;11molPH3转移电子为24mol,则2.2molPH3转移电子为4.8mol,故答案为:硫酸铜;4.8;
(4)II是硫化氢与氧氧化钠反应生成硫化钠,硫化氢是弱电解质,反应的离子方程式为:H2S+2OH-=S2-+2H2O,故答案为:H2S+2OH-=S2-+2H2O;
(5)依据题干信息:硫离子和水反应生成硫代硫酸根离子和氢气,根据硫原子守恒,产物需有因离子,根据原子守恒,产物还有氢氧根离子,反应为:2S2-+5H2O![]() S2O32-+4H2↑+2OH-,故答案为:2S2-+5H2O
S2O32-+4H2↑+2OH-,故答案为:2S2-+5H2O![]() S2O32-+4H2↑+2OH-。
S2O32-+4H2↑+2OH-。

【题目】环境污染已经成为人类社会面临的重大威胁,下列对应关系不正确的是( )
环境问题 | 造成环境问题的主要物质 | |
A | 酸雨 | 二氧化硫、氮氧化物 |
B | 臭氧空洞 | 二氧化碳 |
C | 白色污染 | 塑料垃圾 |
D | 光化学烟雾 | 氮氧化物、碳氢化合物 |
A.A
B.B
C.C
D.D