题目内容
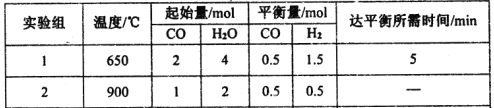
【题目】(1)研究NO2、SO2、CO等大气污染气体的处理具有重要意义。 已知:
2SO2(g)+O2(g) 2SO3(g) ΔH= -196.6kJ·mol-1
2NO(g)+O2(g)![]() 2NO2(g) ΔH= -113.0kJ·mol-1
2NO2(g) ΔH= -113.0kJ·mol-1
则反应NO2(g)+SO2(g)![]() SO3(g)+NO(g)的ΔH= kJ·mol-1
SO3(g)+NO(g)的ΔH= kJ·mol-1
(2)氮是动植物生长不可缺少的元素,合成氨的反应对人类解决粮食问题贡献巨大,反应如下:
N2(g)+3H2(g)![]() 2NH3(g)。
2NH3(g)。
在一定条件下,将一定量的N2和H2的混合气体充入某定容密闭容器中,一段时间后,下列叙述能说明该反应达到平衡状态的是 (填序号)。
A.容器中混合气体的密度不随时间变化 |
B.断裂3 mol H-H键的同时形成6 mol N-H键 |
C.N2、H2、NH3的物质的量之比为1:3:2 |
D.容器中的压强不随时间变化 |
(3)在25 ℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ,则该反应的热化学方程式是____________。
【答案】(1)-41.8 ;(2 ) D;(3 )CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) ΔH=-725.76kJ·mol-1。
【解析】试题分析:(1)已知:①2SO2(g)+O2(g)![]() 2SO3(g)ΔH=-196.6kJ·mol-1;
2SO3(g)ΔH=-196.6kJ·mol-1;
②2NO(g)+O2(g)![]() 2NO2(g)ΔH=-113.0kJ·mol-1。
2NO2(g)ΔH=-113.0kJ·mol-1。
根据盖斯定律:(①-②)÷2得反应
NO2(g)+SO2(g)![]() SO3(g)+NO(g)的ΔH=-41.8kJ·mol-1。
SO3(g)+NO(g)的ΔH=-41.8kJ·mol-1。
(2)A.根据质量守恒定律判断容器内气体的质量保持不变,容器的容积恒定,容器内混合气体的密度为恒量,容器中混合气体的密度不随时间变化不能说明反应达到平衡状态,错误;B.断裂3 mol H-H键的同时形成6 mol N-H键,二者均为正反应速率,不能说明反应达到平衡状态,错误;C.N2、H2、NH3的物质的量之比为1:3:2,反应不一定达到平衡状态,错误;D.该反应正向为气体物质的量减小的反应,等温等容的条件下,随着反应的进行,容器内压强逐渐减小,当容器中的压强不随时间变化说明反应达到平衡状态,正确;选D。
(3)在25 ℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ,1mol甲醇燃烧放热32×22.68kJ=725.76kJ,则该反应的热化学方程式是CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) ΔH=-725.76kJ·mol-1。

 阅读快车系列答案
阅读快车系列答案【题目】常温下,将某一元酸HA溶液和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
实验编号 | HA物质的量浓度(mol·L-1) | NaOH物质的量浓度(mol·L-1) | 混合溶液的pH |
① | 0.1 | 0.1 | pH=9 |
② | c | 0.2 | pH=7 |
③ | 0.2 | 0.1 | pH<7 |
(1)在①组实验中0.1 mol·L-1HA溶液中水的电离程度为a,0.1 mol·L-1NaOH溶液中水的电离程度为b,所得混合溶液中水的电离程度为c.则a、b、c由大到小的顺序是_________.
(2)在②组实验中c_____0.2(填“<”、“>”或“=”)
(3)根据③组实验所得的混合溶液,其溶液中离子浓度大小排列顺序是____________.
(4)常温下,已知KSP[Cu(OH)2]=2×10-20,某CuSO4溶液里c(Cu2+)=0.02 mol·L-1,如果要生成Cu(OH)2沉淀,则应调整溶液pH大于_________.